ACUERDO mediante el cual se da a conocer la actualización de la Carta Nacional Acuícola.
Al margen un sello con el Escudo Nacional, que dice: Estados Unidos Mexicanos.- AGRICULTURA.- Secretaría de Agricultura y Desarrollo Rural.
VÍCTOR MANUEL VILLALOBOS ARÁMBULA, Secretario de Agricultura y Desarrollo Rural, con fundamento en lo establecido por los artículos 1, 2 fracción I, 12, 14, 26, 35 fracciones XXI y XXII de la Ley Orgánica de la Administración Pública Federal; 4 de la Ley Federal de Procedimiento Administrativo; 1, 3, 5, 8 fracción XVIII, 29 fracción V, 83 y 84 de la Ley General de Pesca y Acuacultura Sustentables; 1 del Reglamento Interior de la Secretaría de Agricultura y Desarrollo Rural; Primero, Segundo y Tercero del Decreto por el que se establece la organización y funcionamiento del Organismo Descentralizado denominado Instituto Nacional de Pesca y Acuacultura; así como el 1, 4, 5 y 22 fracción IX del Estatuto Orgánico del Instituto Nacional de Pesca y Acuacultura, y;
CONSIDERANDO
Que la Ley General de Pesca y Acuacultura Sustentables confiere a la Secretaría de Agricultura y Desarrollo Rural (AGRICULTURA), la facultad de aprobar, expedir y publicar la Carta Nacional Acuícola y sus actualizaciones;
Que es atribución del Instituto Nacional de Pesca y Acuacultura (INAPESCA) elaborar y proponer la expedición y actualización de la Carta Nacional Acuícola;
Que la Carta Nacional Acuícola se publicó en el Diario Oficial de la Federación el 31 de enero de 2011 y fue actualizada a través de Acuerdos publicados en dicho medio de difusión el 06 de junio de 2012, 09 de septiembre de 2013 y 15 de abril de 2021;
Que de las investigaciones realizadas por el INAPESCA, se advirtió información relevante para el manejo de los recursos acuícolas que amerita la actualización de diversas fichas técnicas de la Carta Nacional Acuícola, por lo que he tenido a bien expedir el siguiente:
ACUERDO MEDIANTE EL CUAL, SE DA A CONOCER LA ACTUALIZACIÓN DE LA CARTA NACIONAL
ACUÍCOLA
ARTÍCULO PRIMERO.- Se aprueba la actualización de diversas fichas técnicas de la Carta Nacional Acuícola contenidas en el "ANEXO ÚNICO CARTA NACIONAL ACUÍCOLA".
ARTÍCULO SEGUNDO.- El contenido de la Carta Nacional Acuícola tendrá carácter informativo para los sectores productivos y será consultivo y orientador para las autoridades competentes en la resolución de solicitudes de concesiones y permisos para la realización de actividades acuícolas. Las fichas técnicas que no se actualizan continúan vigentes por lo que no pierden su validez.
TRANSITORIO
ÚNICO.- El presente Acuerdo entrará en vigor el día siguiente al de su publicación en el Diario Oficial de la Federación.
Ciudad de México, a 26 de septiembre de 2022.- El Secretario de Agricultura y Desarrollo Rural, Víctor Manuel Villalobos Arámbula.- Rúbrica.
ANEXO ÚNICO "CARTA NACIONAL ACUÍCOLA"
ÍNDICE
1. INTRODUCCIÓN
2. ACUACULTURA COMERCIAL
2.1 Atún aleta azul
2.2 Jurel medregal limón
2.3 Lobina rayada
2.4 Pez payaso
3. ACUACULTURA DE FOMENTO
3.1 Almeja chione
3.2 Espagueti de mar
3.3 Jaiba azul
3.4 Medusa bola de cañón
3.5 Palma de mar
3.6 Robalo blanco
3.7 Sargazo gigante
3.8 Ulva
4. ESPECIES CON POTENCIAL ACUÍCOLA
4.1 Camarón café
5. ESPECIES CON PROTECCIÓN ESPECIAL
5.1 Ajolote
5.2 Caballito de mar del Atlántico
5.3 Caballito de mar del Pacífico
5.4 Corales
5.5 Totoaba
5.6 Trucha nelsoni
6. VOCACIÓN Y POTENCIAL ACUÍCOLA
6.1 Sistema Lagunar de Alvarado
6.2 Laguna de Pueblo Viejo
7. ARTES DE CULTIVO
7.1 Kreisel
8. ANEXO NORMATIVIDAD
8.1 LEYES
8.2 REGLAMENTOS
8.3 NORMAS OFICIALES MEXICANAS
8.4 OTROS
9. INVENTARIO DE LAS ESPECIES ACUÍCOLAS SUSCEPTIBLES DE REPRODUCCIÓN Y CULTIVO
10. BIBLIOGRAFÍA
11. ABREVIATURAS Y SIGLAS
1. INTRODUCCIÓN
La Ley de Desarrollo Rural Sustentable establece que el Estado, a través del Gobierno Federal impulsará políticas, acciones y programas en el medio rural que serán considerados prioritarios para el desarrollo del país y que estarán orientados a corregir disparidades de desarrollo regional a través de la atención diferenciada a las regiones de mayor rezago, mediante una acción integral que impulse su transformación y la reconversión productiva y económica, con un enfoque productivo de desarrollo rural sustentable; además de contribuir a la soberanía y seguridad alimentaria de la nación mediante el impulso de la producción agropecuaria del país.
Mientras que, el artículo 17 de la Ley General de Pesca y Acuacultura Sustentables establece los principios para la formulación y conducción de la Política Nacional de Pesca y Acuacultura Sustentables; entre ellos, que el Estado Mexicano reconoce que la pesca y la acuacultura son actividades que fortalecen la soberanía alimentaria y territorial de la nación, que son asuntos de seguridad nacional y son prioridad para la planeación nacional del desarrollo y la gestión integral de los recursos pesqueros y acuícolas.
En el Plan Nacional de Desarrollo 2019-2024 (PND) en el eje III Economía, establece como una de sus prioridades la Autosuficiencia Alimentaria y el Rescate al Campo, efecto de que la producción agropecuaria y pesquera en general alcance niveles históricos y la balanza comercial del sector agroalimentario sea superavitaria.
Finalmente en el Programa Sectorial de Agricultura y Desarrollo Rural 2020-2024 establece tres estrategias congruentes al PND orientadas a la nueva política agroalimentaria y que están relacionadas con lograr la autosuficiencia alimentaria a través del aumento de la producción agropecuaria, acuícola y pesquera, contribuir al bienestar de la población rural mediante la inclusión de los productores históricamente olvidados e Incrementar las prácticas de producción sostenible en el sector agropecuario y acuícola pesquero frente a los riesgos climáticos.
En el marco anterior, el sector acuícola abarca un conjunto de actividades que tienen origen en el aprovechamiento de los recursos como la flora y fauna acuáticas, es parte del quehacer económico nacional y adquiere vital importancia en la generación de alimentos de alto valor nutritivo, contribuyendo al bienestar de la población, así como en la creación de empleos y en la generación de ingresos para el país.
El sistema de producción de alimentos de mayor crecimiento en las últimas tres décadas en el ámbito internacional y en México ha sido la acuacultura que, como resultado de la diversificación, incremento de la intensidad y su tecnificación con suma rapidez, lo anterior debido en gran medida a que contribuye de manera importante en la producción de alimentos, generación de divisas y la seguridad alimentaria.
Considerando la relevancia de los aspectos que permiten llegar a una producción acuícola sustentable así como los aspectos sanitarios y de inocuidad, en esta versión de la Carta Nacional Acuícola, se presentan junto a las particularidades de la producción, la biología y la tecnología de cultivo, los temas vinculados a los aspectos sanitarios y de inocuidad que permiten diseminar la información respecto a sistemas de producción acuícola, con el objetivo de transferir y validar tecnologías, capacitar personal con la intención de planear, ordenar y fomentar la acuacultura; establecer un sistema de información regional para proveer estrategias adecuadas para la gestión acuícola; promover el intercambio de información y tecnología entre personal científico y técnicos operativos, permitiendo de manera paulatina la incorporación del país a los procesos de desarrollo que faciliten la apertura de mercados.
La quinta versión de la Carta Nacional Acuícola está constituida por fichas técnicas que contienen los siguientes elementos:
I. Generalidades. Contiene información sobre el nombre común y científico de la especie, desarrollo del cultivo.
II. Entidades de cultivo. A nivel nacional se indica en qué estados se desarrolla o dónde se podría realizar el cultivo dada la distribución de la especie.
III. Antecedentes de la actividad. Referencia y antecedentes de la evolución histórica del cultivo y algunos indicadores de la producción.
IV. Información biológica. Describe aspectos sobre la distribución geográfica, morfología, aspectos relevantes del ciclo de vida, hábitat y alimentación en el medio natural.
V. Cultivo - engorda. Indica el desarrollo tecnológico y características del cultivo, así como las artes de cultivo empleados para la especie.
VI. Pie de cría. Alude al origen y procedencia de las crías (semilla), así como los Centros Acuícolas Federales que producen crías para cubrir la demanda nacional.
VII. Alimento. Hace referencia a la disponibilidad de alimento comercial para la especie, o las estrategias empleadas para la alimentación en las distintas etapas de cultivo.
VIII. Parámetros físico-químicos. Muestra los intervalos recomendables de los principales parámetros físico-químicos del agua en que las especies se desarrollan adecuadamente.
IX. Sanidad y manejo. Resalta la importancia de la prevención de enfermedades para evitar mermas en la producción, así como también asegurar la calidad e inocuidad del producto acuícola a través de las buenas prácticas de sanidad acuícola.
X. Mercado. Informa cuáles son las presentaciones del producto en el mercado nacional e internacional, así como sus principales puntos de venta.
XI. Información y trámites. Permite a los usuarios conocer las ligas electrónicas de las instituciones donde pueden consultar información sobre los trámites, autorizaciones y permisos necesarios para cultivar las distintas especies.
XII. Normatividad. Presenta de manera sintetizada las disposiciones legales que rigen a cada especie.
XIII. Manejo ecosistémico. Menciona los lineamientos necesarios para impulsar el desarrollo del cultivo para cada especie
XIV. Investigación y biotecnología. Presenta información orientada a encaminar la investigación y el desarrollo tecnológico del país de acuerdo a las necesidades de cada especie.
XV. Efectos ambientales y cambio climático. Se plantean posibles impactos al cultivo y/o a los organismos de interés y se mencionan recomendaciones ante las variaciones relacionadas al cambio climático.
XVI. Estadísticas de producción. Ilustra gráficamente la evolución de la Producción Nacional Acuícola de cada recurso acuícola y la producción reciente.
La información de los recursos acuáticos que conforman esta Carta se encuentra dividida en ocho grupos:
I. Acuacultura Comercial. Es la que se realiza con el propósito de obtener beneficios económicos.
II. Acuacultura de Fomento. Menciona especies que se cultivan con el propósito de estudio, investigación científica y experimentación en cuerpos de agua de jurisdicción federal, estanques y laboratorios, actividad orientada al desarrollo de biotecnologías y la incorporación de innovaciones tecnológicas, así como la adopción o transferencia de tecnología en alguna etapa del cultivo de especies de flora y fauna, cuyo medio de vida total o parcial sea acuático.
III. Especies con potencial acuícola. Describe características y avances tecnológicos de especies acuáticas que cuentan con ciertas particularidades deseables para el desarrollo de su cultivo.
IV. Especies con protección especial. Menciona especies que se enlistan dentro de una categoría de protección, por lo que su cultivo deberá atender la normativa actual.
V. Vocación y potencial acuícola. En esta sección se describen las principales características físico-químicas y biológicas del sistema, así como una breve descripción de las especies nativas
VI. Artes o sistemas de cultivo. Describe de forma general la infraestructura utilizada para el cultivo de especies acuícolas, sus características, dimensiones, materiales de construcción y las especies que generalmente son cultivadas.
VII. Anexo normatividad general. Presenta un listado de leyes, reglamentos y normas oficiales mexicanas aplicables a la actividad acuícola.
VIII. Inventario de las especies acuícolas susceptibles de reproducción y cultivo. Describe un listado de la última versión vigente de las especies incluidas en las Cartas Nacionales Acuícolas
2. ACUACULTURA COMERCIAL
2.1 Atún aleta azul
Fuente: CONAPESCA-SENASICA (2021)
I. GENERALIDADES
Nombre común: Atún aleta azul, atún cimarrón.
Nombre científico: Thunnus orientalis (Temminck y Schlegel 1844). Sinonimias: Thunnus saliens Jordan y Evermann 1926; Orcynus schlegelii Steindachner 1884.
Nivel de dominio de biotecnología: Parcial (sólo engorda).
Origen: Especie nativa del Pacífico norte oriental, desova y eclosiona en el Mar de Japón y migra a costas de la Península de Baja California en México.
Mercado: Exportación y nacional.
Limitantes técnico-biológicas de la actividad: Biotecnología para la producción de crías y alimento para todas las etapas productivas, disponibilidad de alimento fresco (pelágicos menores), y las cuotas de captura autorizadas.
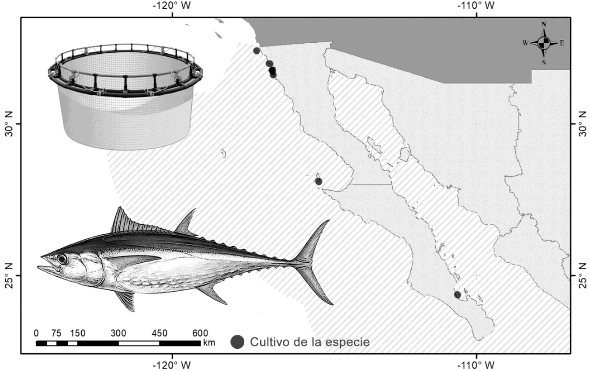
II. ENTIDADES DE CULTIVO
Baja California y Baja California Sur
III. ANTECEDENTES DE LA ACTIVIDAD
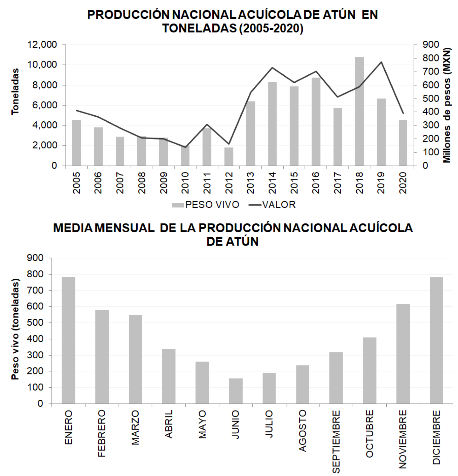
La acuicultura de atún aleta azul (Thunnus orientalis), es una industria que tiene más de 30 años a nivel global, en México la engorda del atún aleta azul (Thunnus orientalis), inició en 1994, con la primera emisión de un título de Concesión para la Acuacultura Comercial (CAC) para la engorda de esta especie mediante el uso de jaulas flotantes o corrales en las inmediaciones de la Isla de Cedros, Baja California. Durante este periodo diecisiete empresas desarrollaron el cultivo de esta especie mediante títulos de CAC, pero a partir del año 2017 solamente seis empresas con su respectivo título de CAC se encuentran en operación con una capacidad autorizada de siembra de 6,720 toneladas anuales en un área de aproximadamente 3,500 hectáreas en aguas de jurisdicción federal. Para el año 2018 su producción acuícola alcanzó su máximo histórico con 8,503 toneladas de peso vivo. Su comercialización es preferentemente eviscerado fresco y super congelado a -60 °C. y se enfoca principalmente en el mercado de exportación, sin embargo, se ha tenido un incremento gradual en el consumo nacional. El objetivo de la actividad es consolidar el cultivo del atún aleta azul (Thunnus orientalis), en una biotecnología completa sin depender de los ejemplares silvestres de atún aleta azul (Thunnus orientalis) de las poblaciones naturales y cultivarlo de manera sustentable.
IV. INFORMACIÓN BIOLÓGICA
Distribución geográfica: Océano Pacífico, distribuyéndose desde las costas del este de Asia hasta las costas de América del Norte.
Morfología: Cabeza moderadamente grande en comparación con el cuerpo de forma larga y puntiaguda, ojos pequeños. El color de su cuerpo va de azul metálico en la mitad superior del cuerpo a plateado en la parte inferior. La primera aleta dorsal es amarilla o azul, y la segunda es roja o café. Las quillas caudales son negras.
Ciclo de vida: Desova al norte del Océano Pacifico Oriental, entre el sur de Japón y norte de Taiwán. Las crías y juveniles son transportados por la corriente de Kuroshio hasta llegar al norte de Japón en el Pacífico subártico. Los organismos pequeños (de un año de edad), migran hacia el Pacifico Oriental frente a las costas de la Península de Baja California en México, donde permanecen de 3 a 5 años hasta alcanzar la madurez sexual para migrar de regreso al Mar de Japón y realizar el desove.
Hábitat: Especie pelágica, oceánica y migratoria. El intervalo de profundidad en la que habita es muy amplio y depende de las variaciones en la cantidad de alimento, temperatura y salinidad, se llega a encontrar desde la superficie hasta 200 m de profundidad.
Alimentación en el medio natural: Carnívoro, se alimenta de peces pelágicos menores (sardina, anchoveta y macarela), calamares, merluza y cangrejo pelágico rojo.
V. CULTIVO - ENGORDA
Biotecnología: Parcial, sólo se realiza la engorda de juveniles capturados del medio natural.
Sistema de cultivo: Intensivo.
Características de la zona de cultivo: Zona costera en áreas principalmente semi-protegidas de la acción directa de los vientos predominantes, con profundidades mayores a 25 m, libres de contaminantes y corrientes marinas de 10 a 20 cm/s.
Artes de cultivo: Jaulas flotantes de 40 a 100 m de diámetro y hasta 15 a 35 m de caída. Sin embargo, estas dimensiones y el diseño de las jaulas pueden variar de acuerdo con las condiciones del área concesionada, cumpliendo en todo momento con la densidad de peces por metro cúbico establecida.
Promedio de flujo de agua para el cultivo: Corrientes de 10 a 20 cm/s para mantener los niveles necesarios de oxígeno y evitar la concentración de residuos dentro de la jaula.
Límite de siembra: Está en función de la disponibilidad del recurso y del número de permisos y concesiones de acuicultura autorizados.
Juveniles para engorda: Se capturan con red de cerco en aguas nacionales entre la latitud 22º y 32º norte, dentro en la Zona Económica Exclusiva de México (Costa Occidental de Baja California y aguas internacionales del Pacifico Norte. La temporada de captura es de Enero a Diciembre de cada año, sin embargo, se debe de cumplir con los periodos de veda establecidos en el ACUERDO por el que se establece veda temporal para la pesca comercial de atún aleta amarilla (Thunnus albacares), patudo o atún ojo grande (Thunnus obesus), atún aleta azul (Thunnus orientalis) y barrilete (Katsuwonus pelamis) en aguas de jurisdicción federal de los Estados Unidos Mexicanos del Océano Pacífico y por el que se prohíbe temporalmente que embarcaciones cerqueras de bandera mexicana capturen dichas especies en alta mar y aguas jurisdiccionales extranjeras que se encuentren en el área de regulación de la Comisión Interamericana del Atún Tropical.
Peso de siembra: Organismos entre 25 y hasta 100 kilogramos.
Porcentaje de sobrevivencia: 95%.
Tiempo de cultivo: 7-24 meses.
Peso de cosecha: Mayor de 60 kg por individuo.
VI. PIE DE CRÍA
Sin información
VII. ALIMENTO
Los atunes de engorda se alimentan con anchovetas (Engraulis mordax) y otras especies de peces pelágicos menores, principalmente sardina Monterrey (Sardinops sagax), sardina crinuda (Opisthonema libertate), sardina japonesa (Etrumeus teres), sardina bocona (Cetengraulis mysticetus), macarela (Scomber japonicus), charrito (Trachurus symmetricus), sardina piña (Oligoplites altus), Calamar Lóligo (Doryteuthis opalescens) y Cangrejo Pelágico Rojo (Pleuroncodes planipes). La ración aproximada es del 3% al 10 % al día, esto depende del peso corporal de los atunes (biomasa estimada).
VIII. PARÁMETROS FÍSICO-QUÍMICOS
| Parámetro | Mín.
| Máx.
|
| Temperatura (°C) | 11.5
| 23
|
| Oxígeno (mg/L) | 5
| 10
|
| Amonio (mg/L) | 1.0
|
| Nitrito (mg/L) | 1.0
|
| Nitrato (mg/L) | 15
|
| Ph | 7.8
| 8.1
|
| Sólidos en suspensión (mg/L) | 20
|
IX. SANIDAD Y MANEJO
Importancia de la sanidad acuícola: Monitoreo constante del agua y del fondo marino para prevenir un impacto potencial por contaminantes y florecimiento de algas nocivas. Las jaulas o corrales deben tener protección contra depredadores (lobos marinos y tiburones) y un anclaje que facilite su movilización por seguridad sanitaria o por amenaza natural. Una vez que termina la engorda, los corrales y redes reciben mantenimiento.
El proceso entre el sacrificio y el enhielado debe tardar menos de 90 segundos y seguir un riguroso protocolo. Los buzos dentro de la jaula o corral capturan los atunes y los entregan al personal a bordo de la embarcación mayor para la inactivación nerviosa y el desangrado. En la planta de proceso, el pescado es enjuagado, pesado, clasificado, eviscerado, marcado, lavado en salmuera, empacado o super congelado a -60 °C.
Para la prevención de enfermedades en los cultivos se recomienda lo siguiente:
I. Monitorear y analizar los organismos en el control de la movilización.
II. Realizar monitoreo bacteriológico del agua de cultivo para llevar a cabo un seguimiento de la carga bacteriana.
III. Prevenir posibles brotes, mediante el tratamiento profiláctico de organismos según corresponda.
IV. Realizar rotaciones de las artes de cultivo durante la engorda en el mar.
V. No exceder la densidad de peces dentro de los corrales de hasta 7 kilogramos por metro cúbico.
Enfermedades reportadas: Nemátodos del género Anisakis spp., tremátodos de las subfamilias Nephrodidymotrematinae y Koellikeriinae, así como acantocéfalos de la familia Polymorphidae, en atunes provenientes de la captura comercial realizada en el Océano Pacífico Oriental en costas mexicanas desde San Carlos, B.C.S., hasta Tijuana, BC También se tienen reportadas las siguientes enfermedades: septicemia hemorrágica viral, iridovirosis de la dorada japonesa y necrosis nerviosa viral.
X. MERCADO
Presentación del producto: Entero fresco eviscerado, entero super congelado a -60 °C.
Precios del producto: El atún se vende aproximadamente entre $160.00 y $240.00 MXN por kilogramo en territorio nacional, sin embargo, puede alcanzar hasta los $20,000.00 USD por tonelada en mercados internacionales. Consultar www.globefish.org (Market reports, Tuna) (Para más información consultar la página: http://www.economia-sniim.gob.mx/SNIIM-pesca/estadisticas/e_pez.asp).
Mercado del producto: La mayor parte del atún aleta azul mexicano se vende principalmente a mayoristas en el mercado de Japón y Estados Unidos de América, y en los últimos años se ha tenido un incremento importante en el consumo nacional.
XI. INFORMACIÓN Y TRÁMITES
Para el desarrollo de la actividad se deberán de realizar los trámites conducentes en Materia de Impacto Ambiental ante la SEMARNAT, así como el trámite de Concesión para la Acuacultura Comercial ante la CONAPESCA para desarrollar la actividad en aguas de jurisdicción federal o el Permiso para la recolección del medio natural de reproductores y organismos acuáticos vivos en cualquier fase de desarrollo destinados para la actividad acuícola.
I. CONAPESCA: www.gob.mx/conapesca
II. SENASICA: www.gob.mx/senasica
III. SEMARNAT: www.gob.mx/semarnat
IV. SCT: https://www.gob.mx/sct
V. SEMAR: https://www.gob.mx/semar
XII. NORMATIVIDAD
Además de revisar el anexo normatividad general, verificar la siguiente normativa específica para la especie:
I. Proyecto de Norma Oficial Mexicana PROY-NOM-021-SAG/PESC-2016, Especificaciones para el aprovechamiento acuícola responsable de atún aleta azul (Thunnus orientalis), en jaulas flotantes en aguas de jurisdicción federal de los Estados Unidos Mexicanos en el Océano Pacífico.
II. ACUERDO por el que se expide el Plan de Manejo para la pesquería de Atún Aleta Azul (Thunnus orientalis, Temminck y Schlegel 1844) en el Pacífico Oriental.
XIII. MANEJO ECOSISTÉMICO
Se sugiere tener en consideración las siguientes prácticas y medidas preventivas que pueden minimizar impactos en las áreas de engorda de atún.
I. Se recomienda utilizar los servicios de una empresa especializada y autorizada, para el manejo de aguas residuales y sanitarias generadas por la operación de barcazas.
II. Realizar el mantenimiento de embarcaciones únicamente en tierra, nunca en la zona y área de influencia del proyecto.
III. Evitar verter hidrocarburos u otros residuos líquidos fortuitos al medio marino procedentes de la operación y mantenimiento de las embarcaciones y artes de cultivo.
IV. Notificar a la CONAPESCA cualquier movimiento de jaulas flotantes con organismos fuera del área autorizada a través del título con el que realice la acuacultura de atún aleta azul (Thunnus orientalis).
V. Se recomienda que cada año las artes de cultivo sean reubicadas al menos 100 m de distancia de su posicionamiento original o bien una vez cosechada y removida una jaula flotante, evitar sembrar en la misma ubicación jaulas del próximo ciclo de cultivo inmediato, lo anterior con la finalidad de evitar la acumulación de materia orgánica en el fondo del mar, en el área de los cultivos.
VI. Evitar la utilización y aplicación de cualquier tipo de sustancia química en el cuerpo de agua, durante la etapa de engorda y procesamiento.
VII. Mantener la engorda de atún aleta azul (Thunnus orientalis), dentro de los parámetros del desarrollo sustentable, que permita generar beneficios económicos y sociales sin afectar el medio ambiente.
VIII. Reducir o eliminar la siembra de organismos menores de dos años o 12 kilogramos.
IX. Incluir el componente de "captura para engorda" en el Plan de Manejo de atún aleta azul existente, y crear una Unidad de Manejo Acuícola, así como desarrollar su Plan de Manejo Acuícola.
X. Realizar estudios de manejo de larvas y crías, de los desoves obtenidos en las jaulas de cultivo.
XIV. INVESTIGACIÓN Y BIOTECNOLOGÍA
Desarrollo tecnológico: Cerrar ciclos de cultivo e impulsar la biotecnología para la producción de crías en laboratorios del país.
Utilizar la tecnología más precisa disponible para evitar la sub y sobre estimación de la biomasa y el número de individuos transferidos a corrales y así poder desarrollar curvas de crecimiento de organismos engordados en jaulas flotantes por un espacio de tiempo.
Sanidad: Continuar con el monitoreo de la calidad del agua donde se ubican los corrales, identificar posibles parásitos y definir su patogenicidad. Desarrollar planes de contingencia en caso de florecimientos algales.
Comercialización: Buscar y expandir a mediano plazo, mercados alternos internacionales, así como nacionales para el producto, con el fin de incrementar el crecimiento de este sector y su valor.
Tecnología de alimentos: Desarrollo de alimento comercial alternativo para esta especie, que no altere el sabor de su carne.
Trazabilidad: Desarrollar e Implementar un sistema de documentación de capturas (SDC) en base a la resolución C-14-06 de la CIAT, para el cumplimiento de las líneas de acción establecidas en el Plan de Manejo para la pesquería del atún aleta azul en el Pacifico Oriental (DOF: 07/04/21) que permita identificar el origen de cada organismo desde su captura, engorda y hasta su comercialización.
XV. EFECTOS AMBIENTALES Y CAMBIO CLIMÁTICO
Como consecuencia de los efectos del cambio climático en el cultivo de peces, se dan las siguientes consideraciones:
Los cambios en la distribución en la composición de las especies y en los hábitats, fomentarán que se realicen modificaciones en las prácticas acuícolas, como serían la ubicación de las instalaciones y el optimizar las prácticas alimenticias.
Como medidas de adaptación, se recomienda lo siguiente:
I. Monitoreo constante de variables fisicoquímicas, temperatura y florecimientos algales en las zonas de cultivo.
II. Contar con planes de contingencia en caso de emergencias sanitarias o por condiciones climáticas adversas relacionadas a fenómenos ambientales atípicos (cambios de temperatura, corrientes, tormentas, etc.)
III. Realizar evaluaciones periódicas del sitio de engorda y en caso de que las variables ambientales no sean favorables para el cultivo del atún aleta azul (Thunnus orientalis) solicitar la modificación del título para realizar la acuicultura en aguas de jurisdicción federal ante la CONAPESCA.
IV. Mejorar la planificación y el emplazamiento de las instalaciones, ajuste al cambio climático, regulación del seguimiento.
V. Desarrollar nuevas dietas para la alimentación y reducir el porcentaje de alimento pelágico.
XVI. ESTADÍSTICAS DE PRODUCCIÓN
Fuente: Anuarios Estadísticos CONAPESCA (2005-2020).
2.2 Jurel medregal limón
I. GENERALIDADES
Nombre común: Jurel, medregal limón, medregal, kahala, pez fuerte, almaco Jack, amber Jack.
Nombre científico: Seriola rivoliana Valenciennes, 1833.
Nivel de dominio de la biotecnología: Ciclo completo.
Origen: Nativos de Baja California Sur, México.
Estatus del cultivo: Completo, se encuentran todas las fases en cultivo.
Mercado: Nacional e internacional.
Limitantes técnico-biológicas de la actividad: Nutrición, falta de información científica.
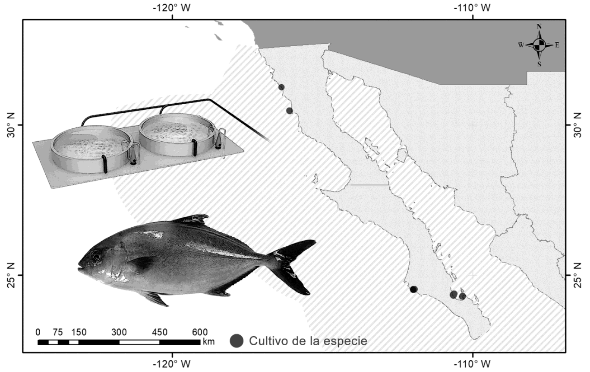
II. ENTIDADES DE CULTIVO
Baja California y Baja California Sur.
III. ANTECEDENTES DE LA ACTIVIDAD
El cultivo del género Seriola comenzó en Japón en los años 50, en 1960 emprendieron el cultivo en jaulas flotantes en el mar. En México, la primera concesión acuícola comercial se registró en 2016, a la fecha hay 4 concesiones activas; 2 en Baja California y 2 en Baja California Sur.
IV. INFORMACIÓN BIOLÓGICA
Distribución geográfica: Son de distribución mundial en las zonas del Pacífico oriental desde el sur de California hasta Perú incluyendo el Golfo de California e islas Galápagos. En el Atlántico Oeste desde Cabo Cod hasta el norte de Argentina.
Morfología: Caracterizado por una cabeza fuerte con un perfil dorsal curvado y boca grande con dientes pequeños, numerosos y dispuestos en bandas tanto en las mandíbulas como en los palatinos, vómer y lengua. El hocico tiene forma redondeada. Su cuerpo es robusto, alargado, fusiforme y algo comprimido lateralmente. El cuerpo está protegido por pequeñas escamas, remarcándose a lo largo de su línea lateral. Se caracterizan por una aleta anal precedida por dos espinas distintas, un pedúnculo caudal delgado, una aleta caudal surcada y escamas en la línea lateral formando un largo arco en posición inferior. Tiene dorso marrón o aceitunado a verde azulado, flancos y vientres más claros en su fase adulta y una franja vertical oscura que atraviesa los ojos hasta la nuca.
Ciclo de vida: Tienen una vida pelágica, la reproducción se realiza en zonas cercanas a la costa y comúnmente se observan a los juveniles debajo de algas y en restos flotantes. Pueden llegar a tener un peso de hasta 80 kg y longitud máxima de hasta 160 cm.
Hábitat: Desde los 20 hasta los 300 m de profundidad.
Alimentación en medio natural: Se alimentan de calamares y de otros peces de menor tamaño como macarela, anchoveta o sardinas.
V. CULTIVO - ENGORDA
Biotecnología: Se tiene el ciclo cerrado, los huevos se obtienen para la siembra de reproductores sexualmente maduros, ya sea del medio silvestre y aclimatados a estanques de reproducción, o bien de reproductores nacidos en cautiverio.
Sistemas de cultivo:
I. Reproductores: Se utilizan estanques con Sistemas de Recirculación Acuícola, con control de temperatura, fotoperiodo, oxígeno, filtración, UV, espumador y biofiltro.
II. Cultivo larvario: Se utilizan estanques con control de temperatura, fotoperiodo, oxígeno y filtración. A su vez, es necesario un área para el cultivo de alimento vivo (rotíferos y artemia).
III. Prengorda: se requieren estanques de mayor tamaño para el crecimiento de los juveniles, con
control de oxígeno y alto recambio de agua.
IV. Engorda: los juveniles cuando alcanzan el tamaño deseado, son trasladados a jaulas marinas para la engorda.
Características de la zona de cultivo: Bahías y zonas costeras tropicales y subtropicales con una profundidad aproximada entre 60 y 80 m, con oleaje moderado y excelente calidad de agua, y una temperatura entre los 22 a 30 °C.
Artes de cultivo:
I. Reproductores: estanques circulares entre 40 a 60 m3.
II. Cultivo larvario: estanques circulares de 2 a 7 m3.
III. Prengorda: estanques circulares de 20 a 30 m3.
IV. Engorda: jaulas marinas circulares de PVC de 10 a 30 metros de diámetro, con sistemas de anclaje y protección anti depredadores.
Promedio de flujo de agua para el cultivo:
I. Reproductores: mínimo de 600% recambio diario.
II. Cultivo larvario: variable, dependiendo de los días post eclosión de las larvas y aumentando conforme crecen.
III. Pre- engorda: alto recambio, variable de acuerdo a la densidad de siembra.
Densidad de siembra: Esta información está en actualización.
Tamaño del organismo para siembra: Se siembran los huevos fecundados y eclosionan en los estanques larvarios.
Porcentaje de sobrevivencia: Variable conforme su crecimiento. Un 30% de sobrevivencia en etapa de prengorda se considera excelente.
Tiempo de cultivo:
I. Larvario: 20 a 30 días dependiendo de la temperatura.
II. Prengorda: 15 a 20 días dependiendo de la temperatura.
III. Engorda: 10 a 12 meses para llegar a talla comercial, dependiendo de la temperatura.
Tamaño promedio de cosecha: 2.2 kg.
VI. PIE DE CRÍA
Origen: La Paz, Baja California Sur.
Procedencia: Reproductores propios en cautiverio.
VII. ALIMENTO
En los reproductores el alimento fresco congelado a saciedad de excelente calidad: sardinas, macarela, lisa, calamar y otros pelágicos menores.
VIII. PARÁMETROS FÍSICO-QUÍMICOS
| PARÁMETRO | INTERVALO ÓPTIMO
|
| Temperatura (°C) | 24 a 26
|
| Salinidad (ups) | 33 a 35
|
| Oxígeno disuelto | 80% saturación mínima
|
| pH | 7.7 a 8.2
|
| Amonio (mg/L) | 0 a 4
|
| Nitritos (mg/L) | 0 a 2
|
| Nitratos (mg/L) | 0 a 25
|
IX. SANIDAD Y MANEJO
Importancia de la sanidad acuícola: El diagnóstico y control de enfermedades en cualquier cultivo son indispensables para su éxito.
Enfermedades reportadas:
I. Bacterianas: Lactococcus spp., Photobacterium spp., Nocardia spp., Mycobacterium spp., Vibrio spp., Tenacibaculum spp., Chlamydia spp., Myxobolus spp.
II. Parasitarias: Microsporidium seriolae, Paradeontacylix sanguinicoloides, Neobenedenia sp., Benedenia sp., Zeuxapta seriolae, Kuda sp.
III. Virales: Yellowtail ascites virus (YAV), Iridovirus (RSIV), Lymphocystis.
Buenas prácticas de producción acuícola:
I. Piscicultura: Uso de estaciones de desinfección para ingreso a las áreas de producción. Monitoreo de parámetros de calidad de agua. Programa de secado y desinfección de instalaciones.
II. Engorda: Monitoreo de parámetros ambientales, programa de monitoreo de enfermedades.
III. Embarcaciones: contar con embarcaciones en buenas condiciones y limpias. El personal que entre en contacto con el producto debe estar en buen estado de salud, contar con un área para almacenar equipos y productos químicos. Llevar bitácora de inspección.
IV. Cosecha: controlar la relación tiempo temperatura del producto después de la cosecha.
X. MERCADO
Presentación del producto: Fresco, eviscerado.
Precios del producto: ND.
Mercado del producto: Nacional e internacional.
XI. INFORMACIÓN Y TRÁMITES
I. SEMARNAT: www.gob.mx/semarnat
II. CONAPESCA: www.gob.mx/conapesca
III. SENASICA: www.gob.mx/senasica
IV. CONAGUA: www.gob.mx/conagua
V. SEMAR: https://www.gob.mx/semar
VI. SCT: https://www.gob.mx/sct
VII. COFEPRIS https://www.gob.mx/cofepris
XII. NORMATIVIDAD
Para esta especie no se cuenta con ninguna normatividad específica, para normatividad general consultar anexo.
XIII. MANEJO ECOSISTÉMICO
El buen manejo de los reproductores permite dejar de depender de la captura de organismos silvestres con lo cual no se afecta los stocks naturales por lo que se pueden producir juveniles en laboratorio para el cultivo comercial de jurel Seriola rivoliana, además esta especie al ser nativa del litoral Pacífico mexicano y no tener ninguna modificación genética, no representa riesgo para el ecosistema en caso de presentarse escapes en las granjas.
La ubicación de las jaulas de engorda es muy importante para determinar el efecto en la calidad del agua y el bentos, por lo regular no hay efectos medibles en el agua después de los 30 metros de distancia de la jaula, esto cuando las granjas están ubicadas en aguas con buen flujo de agua, mientras que el impacto en el fondo puede evitarse colocando la granja en áreas profundas con buen flujo de agua y sobre un fondo erosionable (Price y Morris, 2013).
Es altamente recomendable acceder a certificaciones internacionales como del Aquaculture Stewarship Council y el Best Aquaculture Practices. Estos estándares soportan en conjunto las buenas prácticas de instalaciones acuícolas en los diferentes subsistemas, social, biológico, ambiental y gobernanza, con total apego a las regulaciones nacionales e internacionales y pueden ser también una excelente herramienta de mercado y negociación.
XIV. INVESTIGACIÓN Y BIOTECNOLOGÍA
Desarrollo tecnológico: Líneas de investigación en enfermedades parasitarias y líneas genéticas de rápido crecimiento.
Sanidad: Caracterización de enfermedades, identificación de vectores de infección en poblaciones naturales, así como, uso e implementación de terapias y tratamientos de origen natural que no afecten el medio ambiente y no presenten efectos en el consumidor final.
Comercialización: Certificación de procesos de producción para la obtención de productos de calidad certificada a nivel internacional.
Tecnología de alimentos: Líneas de investigación para la sustitución de proteína animal por proteína de origen vegetal para lograr mayor sustentabilidad en el proceso.
XV. EFECTOS AMBIENTALES Y CAMBIO CLIMÁTICO
Los cambios en la distribución en la composición de las especies y en los hábitats, fomentarán que se realicen modificaciones en las prácticas acuícolas, como serían la ubicación de las instalaciones o el optimizar las prácticas alimenticias.
Como medidas de adaptación, se recomienda lo siguiente:
I. Mejorar la selección de crías para conseguir la tolerancia a temperaturas más altas.
II. Mejorar la planificación y el emplazamiento de las instalaciones, ajuste al cambio climático, regulación del seguimiento.
III. Prevención y seguir las normas sanitarias para prevenir riesgos sanitarios.
XVI. ESTADÍSTICAS DE PRODUCCIÓN
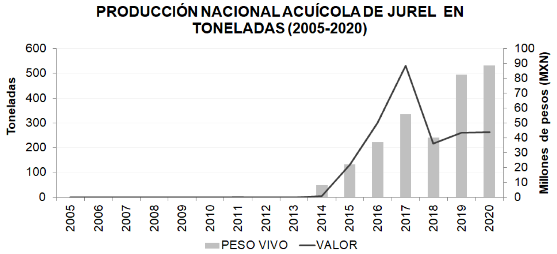
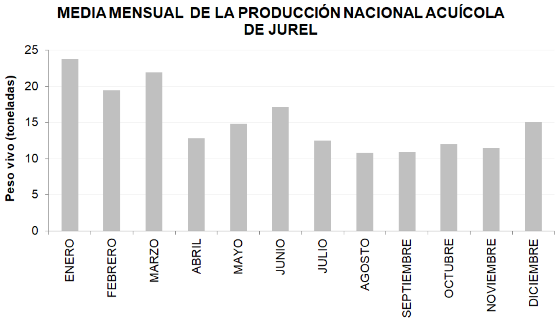
La información publicada de cultivo de jurel es limitada y no es específica para la especie Seriola rivoliana, se presenta la siguiente gráfica elaborada con la información disponible en la página de la CONAPESCA.
Fuente: Anuarios Estadísticos CONAPESCA (2005-2020).
2.3 Lobina rayada
I. GENERALIDADES
Nombre común: Lobina rayada, striped bass.
Nombre científico: Morone saxatilis (Walbaum, 1792)
Nivel de dominio de la biotecnología: Completa, desde la reproducción en laboratorio hasta la engorda en maricultura.
Origen: Se encuentra a lo largo de la costa atlántica de América del Norte. Se introdujo en la costa del Pacifico, donde actualmente se puede encontrar desde México hasta la Columbia Británica (www.cesaibc.org, www.fisheries.noaa.gov, Allen G. et al., 2006)
Estatus del cultivo: Completo.
Mercado: Nacional e internacional (se exporta a Estados Unidos).
Limitantes técnico-biológicas de la actividad: Sin limitantes
II. ENTIDADES DE CULTIVO
Introducida en Baja California.
III. ANTECEDENTES DE LA ACTIVIDAD
El cultivo de peces marinos comenzó en Japón, Canadá, Francia, España y Noruega, hace más de 50 años, llegando a México en los 80's, sin embargo es relativamente reciente en el caso de la lobina rayada. Desde el 2013 una sola empresa en el país se ha dedicado a su producción comercial, contando con su propio laboratorio para abastecerse de juveniles y realiza maricultivo para su engorda.
IV. INFORMACIÓN BIOLÓGICA
Distribución geográfica: Su distribución natural se da en las costas atlánticas de los Estados Unidos, desde la frontera con Canadá hasta la frontera con México (en Golfo de México); en las costas del Pacífico, ha sido introducida (www.sepescabc.gob.mx), en la costa de California hasta el sur de Ensenada, Baja California, México.
Morfología: Cuerpo alargado y ligeramente comprimido, con dos aletas dorsales, la primera con alrededor de 8 espinas dorsales bien diferenciadas, mientras que la segunda presenta entre 10 y 15 espinas cubiertas con una membrana. La boca es grande con apertura oblicua y presenta dientes pequeños en filas. Sobre los flancos posee entre 7 y 8 estrías transversales mayormente marcadas en la mitad superior del cuerpo (www.sepescabc.gob.mx; Fisheries and Oceans Canada, 2011).
Ciclo de vida: La mayor parte de su ciclo vital lo pasan de aguas salobres a oceánicas, sin embargo, dado su estado anádromo, en épocas de reproducción migran a aguas río adentro, donde desovan y eclosionan los huevecillos, pasando toda la etapa larval en agua dulce, y a medida que crece va migrando de nuevo a zonas salobres a oceánicas. Los adultos por lo regular evitan aguas por encima de los 22 °C mientras que los individuos jóvenes pueden tolerar hasta los 29 °C (www.sepescabc.gob.mx).
Hábitat: Es una especie eurihalina, migrador anádromo, es decir, que suele adentrarse en los ríos para desovar (www.sepescabc.gob.mx).
Alimentación en medio natural: Su dieta comprende una amplia gama de especies de peces e invertebrados. Los adultos se alimentan de peces, calamares, moluscos bivalvos, pequeños crustáceos y otros macroinvertebrados, mientras que las larvas se alimentan de zooplancton (www.sepescabc.gob.mx).
V. CULTIVO - ENGORDA
Biotecnología: Completa desde su reproducción en laboratorio hasta la engorda en maricultura.
Sistemas de cultivo: Semi-Intensivo.
Características de la zona de cultivo: Laboratorio: debe estar conformado por áreas de cuarentena, reproductores, incubación, larvarios y fase I, con sistemas de recirculación para mantener las condiciones óptimas de los organismos en todas sus etapas. Maricultura: La zona debe poseer condiciones oceanográficas óptimas (batimetría, corrientes y oleaje) que se combinan para ofrecer una alta capacidad de limpieza. Los residuos que se generan serán eficientemente incorporados a la columna de agua, sin afectar significativamente su calidad fisicoquímica.
Artes de cultivo: En laboratorio se utilizan acuarios, tanques de concreto y fibra de vidrio, mientras que en la maricultura se realiza en jaulas flotantes.
Promedio de flujo de agua para el cultivo: 5 cm/s a 15 cm/s.
Densidad de siembra: Inicial 1 kg/m3 - máxima final 15 kg/m3
Tamaño del organismo para siembra: 4 y 6 gr.
Porcentaje de sobrevivencia: 90%.
Tiempo de cultivo: 18 a 24 meses o hasta que alcancen los requisitos necesarios para su mercado.
Tamaño promedio de cosecha: 0.85 - 1.5 kg.
VI. PIE DE CRÍA
Origen: Laboratorio.
Procedencia: Nacional.
VII. ALIMENTO
La formulación del alimento comercial varía en el contenido de proteínas, grasas y carbohidratos, así como en su tamaño, según la etapa de crecimiento del organismo.
VIII. PARÁMETROS FÍSICO-QUÍMICOS
| PARÁMETRO
| INTERVALO ÓPTIMO
|
| Temperatura (°C) | 15-25
|
| Salinidad (ups) | 0-35
|
| Oxígeno disuelto (mg/L) | 4-10
|
| Amonio (mg/L) | <0.02
|
| Nitritos (mg/L) | <0.2
|
| Nitratos (mg/L) | <2.0
|
| pH | 7.5-8.5
|
IX. SANIDAD Y MANEJO
Importancia de la sanidad acuícola: La prevención de enfermedades es el mejor elemento de control y juega un papel importante en los cultivos acuícolas. Las estrategias deben enfocarse en la prevención más que en el tratamiento de enfermedades.
Enfermedades reportadas: En agua dulce son propensas a septicemia hemorrágica viral (SHV) e iridovirus de la dorada japonesa (RSIV). En maricultivo no se han reportado enfermedades.
Buenas prácticas de producción acuícola: Algunos de los aspectos más relevantes son: a) Realizar cuarentena en organismos de importación de acuerdo con la reglamentación establecida por SENASICA; b) Monitoreo y análisis de organismos para el control de la movilización; c) Monitoreos bacteriológicos de agua de cultivo para llevar un seguimiento de carga bacteriana; d) Prevenir posibles brotes, mediante el tratamiento profiláctico de organismos según corresponda; e) Realizar la rotación de las artes de cultivo en la engorda.
X. MERCADO
Presentación del producto: Entero fresco y congelado, filete fresco, congelado y al alto vacío.
Precios del producto: Los precios pueden variar significativamente desde los 3 dólares por libra hasta los 8 dólares por libra en los mercados de Estados Unidos de América. Sin embargo, los precios dependen en gran medida de la calidad del producto, presentación y el tamaño de las piezas. Para la lobina entera de 0.7 a 1.5 kg, los precios pueden andar en el margen de los $5 a $6.60 USD por kg, para la presentación eviscerado y sin branquias o agallas, los precios oscilan en el margen de los $6.50 a $ 7.50 USD por kilo. Para las piezas de mayor peso entre los 2.7 kilos a los 4 kilos en su presentación de entero, los precios oscilan entre los $8 a $11 USD por kilo y para la presentación eviscerado y sin branquias, los precios oscilan en el margen de los $11.50 a $ 12.50 USD por kilo., Los precios en México oscilan entre los 100 a $250 MXN/kilo, procedente de sistemas de maricultivos.
Mercado del producto: Extranjero, Nacional y Local.
XI. INFORMACIÓN Y TRÁMITES
I. CONAPESCA: www.gob.mx/conapesca
II. SENASICA: www.gob.mx/senasica
III. COFEPRIS: https://www.gob.mx/cofepris
IV. CESAIBC: http://www.cesaibc.org
V. SEPESCABC: http://www.sepescabc.gob.mx
XII. NORMATIVIDAD
Para esta especie no se cuenta con ninguna normatividad específica, para normatividad general consultar anexo.
XIII. MANEJO ECOSISTÉMICO
Establecer el Programa Nacional Acuícola Marino con objetivos dirigidos a la diversificación de las especies marinas de cultivo, que promueva la formación de plantas piloto públicas o privadas para la producción de juveniles, con fines de investigación y de escalamiento a nivel comercial, esta medida reducirá la presión que existe sobre las poblaciones silvestres, permitiendo el reclutamiento y reproducción de los juveniles y subadultos, respectivamente. Se deben implementar medidas de bioseguridad eficientes en el cultivo de especies exóticas para evitar escapes al medio silvestre.
XIV. INVESTIGACIÓN Y BIOTECNOLOGÍA
Desarrollo tecnológico: Completa
Sanidad: No se han detectado agentes causales de enfermedades de importancia económica propios de la especie.
Comercialización: Control y monitoreo de la calidad de los productos que salen a los mercados tanto a nivel local como hacia el extranjero.
Tecnología de alimentos: Completa
XV. EFECTOS AMBIENTALES Y CAMBIO CLIMÁTICO
Los cambios en la distribución en la composición de las especies y en los hábitats, fomentarán que se realicen modificaciones en las prácticas acuícolas, como serían la ubicación de las instalaciones o el optimizar las prácticas alimenticias.
Como medidas de adaptación, se recomienda lo siguiente:
I. Mejorar la selección de crías para conseguir la tolerancia a temperaturas más altas.
II. Mejorar la planificación y el emplazamiento de las instalaciones, ajuste al cambio climático, regulación del seguimiento.
III. Prevención y seguir las normas sanitarias para prevenir riesgos sanitarios.
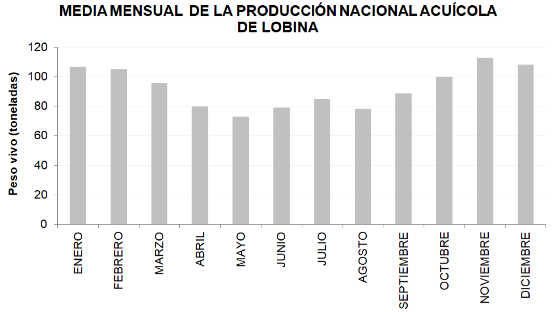
XVI. ESTADÍSTICAS DE PRODUCCIÓN
Fuente: Anuarios Estadísticos CONAPESCA (2005-2019).
2.4 Pez payaso
I. GENERALIDADES
Nombre común: Pez payaso, pez anemona
Nombre científico: Amphiprion sp. y Premnas biaculeatus (Bloch, 1790)
Nivel de dominio de la biotecnología: Cultivo de ciclo completo.
Origen: Indo-Pacífico, Mar Rojo, Australia, Filipinas, Indonesia, Israel.
Estatus del cultivo: Ciclo completo.
Mercado: Nacional y exportación
Limitantes técnico-biológicas de la actividad: Sistemas de cultivo hiperintensivo con control fino de los parámetros.
II. ENTIDADES DE CULTIVO
En la actualidad se tiene registro de una Unidad de Producción en Baja California, sin embargo, se ha registrado su cultivo en los estados de Sinaloa, Veracruz y Yucatán.
III. ANTECEDENTES DE LA ACTIVIDAD
El comercio y exportación de peces tropicales marinos en la acuariofilia comenzó en Sri Lanka en la década de 1930, a muy pequeña escala (Wijesekara & Yakupitiyage, 2001). Posteriormente surge en Estados Unidos, con la instalación de criaderos cercanos a zonas costeras como Instant Ocean Hatcheries (1974-1985), Aqualife Research (1972) y Sea World (1964) (Hoff, 1985). Si bien el pez payaso era ya considerado como una especie de importancia ornamental, a raíz de la demanda surgida en 2003 el cultivo tiene un incremento notable.
IV. INFORMACIÓN BIOLÓGICA
Distribución geográfica: Indo-Pacífico, Mar Rojo, Australia, Filipinas, Indonesia, Israel, etc.
Morfología: Fusiformes, comprimidos transversalmente, poseen 3 bandas que cruzan verticalmente su cuerpo bordeadas por una franja negra y una aleta caudal redondeada.
Amphiprion sp.: Van desde los 8 a los 18 cm dependiendo de la especie. Cuentan con diferentes colores y patrones regularmente son tres franjas blancas bordeadas por una línea negra, tienen de 9 a 11 espinas en la aleta dorsal, la parte espinosa anterior tiene una altura que va desde 2.1 a 3.3 cm en la longitud de la cabeza. La coloración de los ojos puede ser naranja brillante o gris, dependiendo de la especie.
Premnas biaculeatus: Cuentan con diferentes coloraciones según la variedad. Una variedad sería la "White band" o banda blanca, y la otra es denominada como "Golden strip", debido a la coloración amarillo / dorada de sus bandas, que van acentuándose conforme avanza hacia la madurez el animal. El cuerpo y las aletas son de un color rojo intenso y vivo en los machos y ejemplares juveniles, siendo más pardo y cercano al negro en las hembras.
Cuenta con 10 espinas y 17-18 radios blandos dorsales, 2 espinas y 13-15 radios blandos anales. Tienen una distintiva espina preopercular a cada lado de la cara.
Alcanza los 17 cm de longitud, en el caso de las hembras, que, como en todas las especies de pez payaso, son mucho mayores que los machos. Su tamaño habitual de adulto es de 13 cm.
Ciclo de vida: Son hermafroditas protándricos, es decir, los machos se convierten en hembras, ovíparo de fertilización externa, con parejas distintivas durante el apareamiento (una vez que la pareja está formada suelen ser monógamos). Desovador bentónico, los huevos son demersales y se adhieren a un sustrato. Los machos cuidan y airean los huevos.
Hábitat: Arrecifes de coral o rocosos tropicales, viven entre los tentáculos venenosos de anémonas grandes. Regularmente ocurren en aguas someras y lagunas (1 a 15 m de profundidad). Son peces no migratorios.
Alimentación en medio natural: Considerados omnívoros generalistas, se alimentan de plantas, invertebrados bentónicos y zooplancton. También llegan a consumir los parásitos de sus anémonas anfitrionas.
V. CULTIVO - ENGORDA
Biotecnología: Completa, se realiza el cultivo de ciclo completo desde la inducción a la maduración de los reproductores, desove, eclosión, alevinaje y engorda.
Sistemas de cultivo: Hiperintensivos.
Características de la zona de cultivo: Al ser una especie no nativa de México, el cultivo se debe realizar en tanques con sistema de circulación cerrada.
Artes de cultivo: Tanques y peceras de 40 a 1000 L.
Promedio de flujo de agua para el cultivo: Los tanques deben de filtrar/recircular el agua en una tasa de 4 veces el volumen del tanque por hora.
Densidad de siembra: Una pareja por tanque de 40 L.
Tamaño del organismo para siembra: Reproductores macho 5 cm y hembra hasta 10 cm.
Porcentaje de sobrevivencia: 70 - 95%.
Tiempo promedio de engorda: 4 a 7 meses desde el alevinaje a la talla comercial.
Tamaño promedio de cosecha: de 3 a 6 cm.
VI. PIE DE CRÍA
Origen: Preferentemente del medio natural en el caso de variedades que no son de diseño y de acuacultura en otros países en el caso de variedades de diseño.
Procedencia: Nacional y EE.UU.
VII. ALIMENTO
Rotíferos en las primeras etapas de alevinaje, nauplios de artemia y alimento balanceado con adición de pigmentos para la estimulación de la coloración.
VIII. PARÁMETROS FÍSICO-QUÍMICOS
| PARÁMETRO
| INTERVALO ÓPTIMO
|
| Salinidad (ups)
| 32
|
| Nitratos, amonio y fosfatos (mg/L)
| 0
|
| pH
| 8 a 8.3
|
| Temperatura (°C)
| 25 a 27
|
| Oxígeno disuelto (mg/L)
| 5 a 10
|
IX. SANIDAD Y MANEJO
Importancia de la sanidad acuícola: El control en los parámetros fisicoquímicos debe ser estricto para evitar estrés en los organismos y no comprometer su sistema inmune.
Enfermedades reportadas: Las principales enfermedades son parasitarias externas (hongos y protozoarios) de las especies Cryptocaryon irritans, Oodinium sp., y distintos hongos que afectan la piel principalmente.
Buenas prácticas de producción acuícola: Medidas sanitarias como son uso de tapetes sanitarios, bata, guantes, botas, no uso de perfumes, uso de herramientas y artículos de limpieza exclusivo por sistema para evitar contagios.
X. MERCADO
Presentación del producto: Vivo, empacado en bolsas con agua y oxígeno y dentro de cajas térmicas.
Precios del producto: de $30 a $500 MXN dependiendo de especie y variedad.
Mercado del producto: Nacional e internacional.
XI. INFORMACIÓN Y TRÁMITES
I. SEMARNAT: www.gob.mx/semarnat
II. CONAPESCA: www.gob.mx/conapesca
III. SENASICA: www.gob.mx/senasica
IV. CONAGUA: www.gob.mx/conagua
XII. NORMATIVIDAD
Para esta especie no se cuenta con ninguna normatividad específica, para normatividad general consultar anexo.
XIII. MANEJO ECOSISTÉMICO
Estos peces son organismos cultivados que no están presentes en México, por lo que es conveniente:
I. No se permite la liberación o introducción a los hábitats y ecosistemas naturales de especies exóticas invasoras.
II. No se autoriza la importación de especies exóticas invasoras o especies silvestres que sean portadoras de dichas especies invasoras que representan una amenaza para la biodiversidad, la economía o salud pública.
III. Sistema de monitoreo para la detección temprana de especies exóticas en ambientes naturales.
IV. Promover la capacitación en temas como el mejoramiento productivo, la prevención y control de enfermedades y la aplicación de medidas de bioseguridad.
V. Programa permanente de educación ambiental.
VI. Fomentar el intercambio de ejemplares no deseados, con el fin de evitar la liberación de estos ejemplares por parte de acuaristas hacia ambientes acuáticos naturales.
XIV. INVESTIGACIÓN Y BIOTECNOLOGÍA
Desarrollo tecnológico: Mayor tecnificación en los sistemas de cultivo que contemplen un control fino de los parámetros que afectan al pez payaso durante todas las etapas de su cultivo.
Sanidad: Monitorear los sistemas de cultivo en todas las etapas (reproductores, alevinaje y engorda), determinar la incidencia de los distintos parásitos y enfermedades.
Comercialización: Incrementar las ventas nacionales e internacionales a través de mejorar la calidad y características de los peces payaso para que sean competitivos.
Tecnología de alimentos: Desarrollar alimentos que estimulen sistema inmune, crecimiento acelerado y coloración adecuada.
XV. EFECTOS AMBIENTALES Y CAMBIO CLIMÁTICO
Los cambios en la distribución en la composición de las especies y en los hábitats, fomentarán que se realicen modificaciones en las prácticas acuícolas, como serían la ubicación de las instalaciones o el optimizar las prácticas alimenticias.
Como medidas de adaptación, se recomienda lo siguiente:
I. Mejorar la selección de crías para conseguir la tolerancia a temperaturas más altas.
II. Mejorar la planificación y el emplazamiento de las instalaciones, ajuste al cambio climático, regulación del seguimiento.
III. Prevención y seguir las normas sanitarias para prevenir riesgos sanitarios.
XVI. ESTADÍSTICAS DE PRODUCCIÓN
En datos de anuarios estadísticos no se cuenta información específica para estas especies sin embargo a partir del 2013 se tienen registros como categoría "peces de ornato" por parte de CONAPESCA:
Fuente: Anuarios estadísticos 2005-2017
3. ACUACULTURA DE FOMENTO
3.1 Almeja chione
I. GENERALIDADES
Nombre común Nombre científico
Almeja negra Chione fluctifraga (Sowerby, 1853)
Almeja piedrera Chione californiensis (Broderip, 1835)
Almeja arenera Chione cortezi (Carpenter, 1864)
Almeja china Chionopsis gnidia (Broderip & Sowerby I, 1829)
Almeja roñosa Chione undatella (Sowerby, 1853)
Nivel de dominio de la biotecnología: Parcial (dominada la producción de semilla, falta validar la biotecnología de prengorda y engorda).
Origen: Nacional.
Estatus del cultivo: Fomento (existió una concesión comercial de Chione spp, en Sonora, actualmente su práctica es por acuacultura de fomento).
Mercado: Nacional e internacional.
Limitantes técnico-biológicas de la actividad: Validación de artes de cultivo y tecnología para prengorda y engorda.
II. ENTIDADES DE CULTIVO
Baja California, Sonora y Sinaloa.
III. ANTECEDENTES DE LA ACTIVIDAD
El cultivo de almeja Chione spp. se inició en el 2008, con la producción de dos millones de semillas en el laboratorio del Centro Reproductor de Especies Marinas del Estado de Sonora (CREMES), el cual es el principal productor de esta especie a nivel nacional, utilizando reproductores silvestres. Sonora es el principal productor de esta especie por acuacultura, con un promedio anual de 313 toneladas en el periodo 2010-2018. Baja California y Sinaloa se han incorporado a la práctica de la acuacultura de fomento de Chione spp, pero su producción aun es baja.
IV. INFORMACIÓN BIOLÓGICA
Distribución geográfica: En general el género Chione se distribuye en aguas templadas y subtropicales de ambas costas de América, en el Atlántico, desde el este de Carolina del Norte, Golfo de México, Campeche, hasta Brasil y en las costas del Pacífico desde San Pedro, California, incluyendo el Golfo de California hasta Perú.
En el caso particular de la almeja negra Chione fluctifraga se distribuye desde el sur de California (Estados Unidos), costa del Pacífico de la Península de Baja California y Golfo de California).
La almeja roñosa, Chione californiensis, su distribución comprende desde Santa Bárbara, California, EE.UU., a través del Golfo de California, hasta Acapulco, Guerrero, México. Se encuentra desde la zona intermareal hasta los 90 m de profundidad en fondos arenosos.
Almeja arenera Chione cortezi se distribuye del Golfo de California hasta Bahía Magdalena, Baja California Sur. Algunos investigadores la citan como especie endémica del Alto Golfo de California.
Morfología: El cuerpo de estos organismos está cubierto por dos valvas. En Chione fluctifraga el color de sus valvas en la superficie externa es de gris a blanco con el interior arrugado, radiaciones oscuras y corrugadas. Tiene bien marcadas las líneas. Longitud de 5 cm. en Chione californiensis la concha blanca presenta puntos cafés, radiaciones y rallas alrededor de toda la concha, por dentro es azul. Longitud de 6 cm. y Chione undatella es similar a la C. californiensis excepto por las líneas que están más separadas entre sí y están menos pronunciadas. Usualmente con dos a cuatro líneas cafés con una longitud de 5.5 cm. La almeja género Chione tiene una altura que oscila entre 4 y 7 cm, una longitud de 4 a 6 cm en adultos, una concha subtrigonal, y moderadamente comprimida, de color cremoso, con costillas concéntricas cuyos márgenes se prolongan hacía la parte ventral, cuenta con costillas radiales semigruesas y espaciadas, lúnula estriada en forma de corazón y un escudete en forma de "V". La región dorsal posterior no es lisa y está sobrepuesta con la valva izquierda, los umbos son englobados y poco pronunciados, el ligamento externo es abultado y la parte interna de la concha es de un color cremoso. La parte interior de las valvas es lisa de color blanco opaco, con una mancha color púrpura o marrón cerca del margen posterior, pueden presentar una coloración naranja en el área paleal, la cicatriz anteroposterior es más profunda, la línea paleal es redondeada y unida a la cicatriz anterior posterior, la charnela es de tipo heterodonta con un par de dientes grandes, margen interno amplio y dentado.
Ciclo de vida: Tiene un ciclo reproductivo semianual, caracterizado por el desarrollo de varias cohortes ovocitarias así como desoves continuos. Presenta cinco estadios de desarrollo gametogénico: gametogénesis temprana, crecimiento, madurez, desove y absorción. Se inicia en marzo con la primera cohorte. Se muestra mayor actividad reproductiva con ovocitos en la etapa de crecimiento, maduración y reabsorción de marzo a octubre cuando la temperatura es mayor a 25°C. El inicio de los desoves en Chione fluctifraga en Sonora, se han detectado desde abril cuando la temperatura del agua llegó a 21°C, hasta julio-agosto cuando la temperatura alcanza los máximos de 29-30°C, y se registran los principales picos de desove.
Hábitat: El hábitat preferido o las abundancias mayores se han registrado en arena fina a muy fina. Pocos ejemplares se encuentran en sedimentos limosos y no hay en arena gruesa. Viven enterradas de 10 a 20 cm, se les puede encontrar formando bancos desde la zona intermareal hasta los 90 m de profundidad.
Alimentación en medio natural: Su alimentación es por filtración. Exclusivamente de fitoplancton bentónico como diatomeas, silicoflagelados y dinoflagelados. Posiblemente de materia orgánica cuando la disponibilidad de fitoplancton es escasa.
V. CULTIVO - ENGORDA
Biotecnología: La tecnología para el cultivo del género Chione se encuentra en desarrollo a través de proyectos de acuacultura de fomento e investigaciones que lleva a cabo el Instituto Nacional de Pesca y Acuacultura
Sistemas de cultivo: Intensivo.
Características de la zona de cultivo: La zona de cultivo son generalmente esteros y frentes de playa de fondos de arena fina a limo arcilloso.
Artes de cultivo: Las artes de cultivo que se están probando en la etapa de prengorda son: Canastas Nestier con sobres de malla mosquitera, en fondo y suspensión, Javas plásticas con sedimento, bolsas plásticas en suspensión y "FLUPSY's" (Floating Upweller System) por sus siglas en inglés.
En engorda, se están evaluando las canastas Nestier con sedimento, tapete de malla mosquitero con sedimento, y libres en el fondo con cerco perimetral de malla plástica.
Promedio de flujo de agua para el cultivo: Variable dependiendo de la zona de cultivo.
Densidad de siembra: No está definida, se han tenido resultados favorables a densidades de tres mil semillas por m2, en la etapa de prengorda.
Tamaño del organismo para siembra: 3-5 mm.
Porcentaje de sobrevivencia: No está definida, se han logrado sobrevivencias del 90% a la talla de 1 cm en prengorda.
Tiempo de cultivo: 2-3 años dependiendo de la especie.
Tamaño promedio de cosecha: 40 mm.
VI. PIE DE CRÍA
Origen: Nacional.
Procedencia: Laboratorio Centro Reproductor de Especies Marinas del Estado de Sonora (CREMES), cuenta con la tecnología para producir semilla de Chione spp.
VII. ALIMENTO
Fitoplancton bentónico como diatomeas, silicoflagelados y dinoflagelados que provienen del medio natural. Posiblemente de materia orgánica cuando la disponibilidad de fitoplancton es escasa.
VIII. PARÁMETROS FÍSICO-QUÍMICOS
| PARÁMETROS | INTERVALO
|
| Temperatura (°C) | 14 - 30
|
| Oxígeno (mg/L) | 6 - 9
|
| pH | 7.8 - 8.4
|
| Salinidad (ups) | 36 - 43
|
IX. SANIDAD Y MANEJO
Importancia de la sanidad acuícola: Previene las enfermedades y favorece la inocuidad de los organismos acuáticos cultivados y silvestres, para evitar efectos negativos en la producción y los consumidores. Asegura la calidad e inocuidad del producto acuícola a través de buenas prácticas de manejo, preventivas, y control de agentes infecciosos.
Enfermedades reportadas: Herpesvirus del Ostión, Bonamia exitiosa, Bonamia ostrae, Perkinsus marinus, Perkinsus olseni, Marteilia refringens, Mikrocytos mackini, Haplosporidium nelsoni, Enfermedades bacterianas y enfermedades virales.
Buenas prácticas de producción acuícola: Hay que considerar los siguientes aspectos: a) Procesos que logren la producción de moluscos inocuos; b) Selección adecuada del sitio de cultivo; c) Manejo adecuado de la salud de los organismos; d) Operaciones adecuadas durante el ciclo productivo que minimicen perturbaciones ambientales (biológicas o químicas) y e) Medidas de bioseguridad para proteger la salud de los moluscos bivalvos. Mayor información: Manual de Buenas Prácticas en la Producción Acuícola de Moluscos Bivalvos para la Inocuidad Alimentaria (www.senasica.gob.mx/?id=1642).
Buenas prácticas e higiene: Para protección de la salud pública, es necesario consultar la Guía Técnica del Programa Mexicano de Sanidad de Moluscos Bivalvos de la COFEPRIS, así como las disposiciones obligatorias y lineamientos en materia de buenas prácticas de higiene, disponibles en las páginas electrónicas: https://www.gob.mx/cms/uploads/attachment/file/313621/GuiaTPCSMB.pdf.
Impacto Ambiental:
Operaciones adecuadas durante el ciclo productivo que disminuyan perturbaciones ambientales (biológicas o químicas).
Realizar el mantenimiento y limpieza de estructuras de cultivo únicamente en tierra, nunca en la zona y área de influencia del proyecto
X. MERCADO
Presentación del producto: Entero vivo fresco y empacado en bolsas de plástico y cajas de cartón para su exportación.
Precios del producto: A nivel nacional la pieza alcanza los $0.50 MXN, mientras que en exportación se cotiza la libra (10 almejas) en un promedio de $1.25 USD.
Talla promedio de presentación: 40 mm.
Mercado del producto: Local, regional e Internacional.
XI. INFORMACIÓN Y TRÁMITES
VIII. CONAPESCA: www.gob.mx/conapesca
IX. SENASICA: www.gob.mx/senasica
X. SEMARNAT: www.gob.mx/semarnat
XI. CONAGUA: www.gob.mx/conagua
XII. COFEPRIS https://www.gob.mx/cofepris
XII. NORMATIVIDAD
Además de considerar el anexo de normatividad general, revisar la siguiente normativa específica para la especie:
NORMA OFICIAL MEXICANA NOM-031-SSA1-1993, Bienes y servicios, Productos de la pesca. Moluscos bivalvos frescos-refrigerados y congelados. Especificaciones sanitarias.
XIII. MANEJO ECOSISTÉMICO
Se sugiere tener en consideración las siguientes prácticas y medidas preventivas que pueden minimizar los impactos ambientales en las áreas de cultivo.
I. Realizar las actividades de captura y cultivo en zonas clasificadas sanitariamente por el Programa Mexicano de Sanidad de Moluscos Bivalvos (PMSMB).
II. Atender los lineamientos del Programa Mexicano de Sanidad de Moluscos Bivalvos (PMSMB), observando los criterios ecológicos de calidad del agua (CE-CCA-001/89, D.O.F. 13/XII/1989), particularmente en lo referente a acuacultura de moluscos bivalvos.
III. Operaciones adecuadas durante el ciclo productivo que minimicen perturbaciones ambientales (biológicas o químicas).
IV. Realizar el mantenimiento y limpieza de estructuras de cultivo únicamente en tierra, nunca en la zona y área de influencia del proyecto.
V. Evitar verter hidrocarburos u otros residuos al medio marino procedentes de la operación y mantenimiento de las embarcaciones.
XIV. INVESTIGACIÓN Y BIOTECNOLOGÍA
Desarrollo tecnológico: Es importante desarrollar estudios para fortalecer el aprovechamiento de los recursos mediante la acuacultura en forma sustentable y con un manejo ecosistémico, por ello se considera importante.
Genética: Producir semilla triploide para evaluar las ventajas en cuanto a crecimiento y sobrevivencia en relación a la semilla diploide.
Manejo: Mejorar la competitividad en el cultivo de almeja a través de la investigación y la innovación tecnológica.
Ecología: Determinar la capacidad de carga de los sistemas en donde se desarrollen los cultivos para no afectar a especies nativas.
Especies nativas: desarrollar programas de repoblamiento para recuperar las poblaciones silvestres.
Inocuidad: Promover investigaciones en materia de inocuidad y salud pública.
Tecnología de cultivo: Desarrollar investigaciones sobre densidades óptimas por arte de cultivo y especie.
Sanidad: Promover la aplicación de Análisis de Riesgos y Control de Puntos Críticos (HACCP, por sus siglas en inglés) a los procesos de manejo durante la producción, cosecha y empaque.
Tecnología de alimentos: Diseñar procesos para dar valor agregado al producto (ahumado enlatado, fresco al alto vacío), y dar mayor difusión para incrementar su consumo en el mercado nacional e internacional.
XV. EFECTOS AMBIENTALES Y CAMBIO CLIMÁTICO
El cambio climático como un resultado del efecto invernadero del planeta, provoca la acidificación de los mares y modifica el ciclo del oxígeno ocasionando bajas de este en la zona costera, poniendo en riesgo el desarrollo de los cultivos intensivos donde la demanda de oxígeno es alta, por ello es necesario realizar estudios para la adecuada ubicación y detección de zonas de riesgo.
XVI. ESTADÍSTICAS DE PRODUCCIÓN
3.2 Espagueti de mar
I. GENERALIDADES
Nombre común: Espagueti de mar, vidrillo.
Nombre científico: Gracilaria pacifica I.A.Abbott 1985.
Nivel de dominio de la biotecnología: Completo.
Origen: Gracilaria pacifica, es una de las especies más comunes a lo largo de la costa del Pacífico de Norteamérica; se distribuye desde Alaska hasta Baja California, México (Scagel et al., 1989).
Estatus del cultivo: Experimental.
Mercado: Exportación como materia prima para la producción de agar. Como forraje para abulón en cultivo.
Limitantes técnico-biológicas de la actividad: La posibilidad de desarrollar cultivos dependerá de poder controlar su crecimiento, reproducción y ciclo de vida.
II. ENTIDADES DE CULTIVO
En algunas zonas costeras de Baja California donde hay condiciones apropiadas para el cultivo.
III. ANTECEDENTES DE LA ACTIVIDAD
El género Gracilaria, es de amplia distribución en México, a partir de praderas naturales, se ha aprovechado para exportarse a Japón como materia prima para la producción de agar, particularmente de praderas del Golfo de California y Laguna San Ignacio, aunque su aprovechamiento actual no es sostenido. En el Pacífico norte, en épocas en que escasean otras algas, es usada para alimento en cultivos comerciales de abulón y erizo, ya que aporta niveles altos de proteínas. Actualmente a pesar de que se tiene el dominio de la tecnología de cultivo, no hay en México cultivos comerciales de esta especie.
IV. INFORMACIÓN BIOLÓGICA
Distribución geográfica: Este género, se encuentra principalmente en las costas del Pacífico en Norteamérica, Sudamérica y China. En México se distribuye en la región templada del Pacífico desde la frontera con Estados Unidos hasta la zona de Bahía Tortugas en BCS, Golfo de California y Sinaloa (Dreckmann y Sentíes, 2014). Habita desde la superficie hasta los 10 m de profundidad, con mayor frecuencia enterrados en la arena y en bahías protegidas con fondos arenosos o fangosos, y en algunos casos adheridas a sustratos duros.
Morfología: Poseen un talo bien definido en ejes, ramas y un pie de fijación. Los ejes son producidos a partir de una germinación espórica tipo Dumontia; es decir, una vez adherida al sustrato, la espora se divide una o más veces en un plano perpendicular a éste y luego se producen divisiones horizontales que dan lugar a una masa hemisférica de células al interior de la pared celular original, lo que a su vez da lugar a la costra polistromática de la que surgen uno o más ejes erectos. Los ejes y ramificaciones del talo pueden, en corte transversal, ser cilíndricos, completamente aplanados, laminares, o presentar una condición intermedia, comprimida. La estructura anatómica es pseudoparenquimatosa con desarrollo de subcorteza y corteza (Dreckmann y Sentíes, 2014).
Ciclo de vida: El género Gracilaria tiene un ciclo de vida trifásico con alternancia de generaciones isomórficas (asexual- sexual y cistocárpico). En la reproducción sexual participan individuos separados, esto es gametofitos masculinos y gametofitos femeninos, ambos son organismos haploides (n); en la fecundación las plantas masculinas producen espermacios (gametos masculinos) que fecundan la oogonia (gameto femenino); esta fecundación da origen a la siguiente fase reproductiva, la fase cistocárpica (2n), la cual se desarrolla sobre la planta femenina.
Dentro del cistocarpo, se forman las carposporas diploides (2n); cuando el cistocarpo madura, las carposporas son liberadas al medio ambiente; estas se asientan, germinan y crecen formando gametofitos femeninos o masculinos cerrando el ciclo de vida. Los gametofitos masculinos, femeninos y los tetraesporofitos tienen una morfología similar o sea son isomórficos. En poblaciones naturales y en cultivos es posible encontrar individuos estériles o indiferenciados y son estos estados fenológicos que dominan la población en algunos cultivos comerciales.
Hábitat: Esta especie, habita bahías protegidas con fondos arenosos. Tiene gran tolerancia a cambios de temperatura y salinidad, razón por la que vive y crece en diferentes ambientes, salinos y estuarinos, intermareales y submareales.
Alimentación en medio natural: Estos organismos efectúan fotosíntesis, por lo cual, aprovechan la luz solar y los nutrientes de las aguas en que se desarrollan tales como: nitrógeno, fósforo, carbono, entre otros.
V. CULTIVO - ENGORDA
Biotecnología: Se cuenta con la biotecnología completa tanto para el cultivo extensivo en el mar como intensivo en estanques en tierra.
El cultivo de esta especie, se puede realizar por dos rutas, una por reproducción vegetativa (cultivo clonal), donde material proveniente de las praderas silvestres, se colecta, se trocea y se distribuye en el sustrato arenoso semienterrados en pequeños manojos de 200 a 250 g para un total de 2000 g/m2. Para cultivos semi-intensivos o intensivos se utilizan densidades iniciales de 2-3 kg por m2.
La otra ruta corresponde a la reproducción por esporas, esta también es de dos vías, la primera de ellas corresponde a la generación gametofita, el material reproductivo se colecta de praderas silvestres, donde se seleccionan talos cistocárpicos (plantas femeninas con estructuras reproductivas visibles), en laboratorio se limpian con agua dulce; se induce la liberación de carposporas en tanques de cultivo donde se encuentran carretes de cuerda de nylon de aprox. 3mm de diámetro para la fijación de las carposporas, después se dejan reposar de 24 a 48 h en oscuridad total a temperaturas entre 10 y 12 °C posteriormente, las cuerdas se pasan al campo donde la cuerda se extiende en el sustrato para el crecimiento de las plantas; en este caso se generan plantas esporofíticas.
La otra vía que parte de esporas, corresponde a la generación tetraspórica, para ello también de praderas naturales, se colectan talos esporofitos (con soros visibles que contienen las tetrasporas), igual que en la otra vía el material se hace lavar, se induce la liberación de las tetrasporas y su fijación en la cuerda de nylon que después será trasladada al medio natural para su desdoblamiento y crecimiento, en este caso se originan los talos gametofitos masculinos y femeninos.
Sistemas de cultivo: Gracilaria puede ser cultivada de manera extensiva en planicies costeras someras que queden o no expuestas en marea baja. Manojos de Gracilaria de 100 a 200 g pueden enterrarse parcialmente de manera directa en el sustrato o entrelazarse en cuerdas de polipropileno suspendidas a 1m del bentos con ayuda de estanques de donde se suspendan las cuerdas. Las cuerdas se colocan de manera paralela, separadas alrededor de 25 cm. La densidad de los cultivos deberá de probarse experimentalmente y podrá variar de acuerdo a la productividad de cada sitio. Los cultivos se cosecharán cuando superen el 100% de biomasa, lo cual, dependiendo de la época del año y la productividad del sitio podrá ocurrir en un periodo de tres a seis semanas durante la época de crecimiento.
Gracilaria se puede cultivar de manera semi-intensiva o intensiva en estanques en tierra o efluentes de granjas de peces, abulones u otros organismos acuáticos. En estanques que permitan la resuspensión continua de las algas en la columna de agua mediante la inyección de aire desde el fondo, las densidades iniciales de cultivo serán de 2-3 kg por m3. Este tipo de cultivos típicamente requieren de la adicción de fertilizantes como fuente de nitrógeno y fósforo, así como recambios continuos de agua. La productividad de estos cultivos puede ser mayor a 15 g/m2/día (peso seco).
Tanto los cultivos en estanques como en el mar de Gracilaria pueden integrarse a otros cultivos en sistemas multitróficos donde las algas pueden desempeñarse como biofiltros además del uso que pueda darse a su cosecha.
Características de la zona de cultivo: Después que a las cuerdas se le han fijado las esporas ya sea gametofitos o esporofitos, pueden tener un periodo de aclimatación-crecimiento en tanques exteriores con suministro de aire, agua de mar circulante y suministro de nutrientes. Posteriormente se traslada al mar en zonas limpias libres de descargas antropogénicas y corrientes moderadas.
Artes de cultivo: Va de acuerdo a las diferentes etapas de cultivo, en la etapa de inoculación se hace en cámaras a nivel laboratorio; posteriormente se usan tanques o piletas con agua corriente y burbujeo y a final de cuentas, las cuerdas con los organismos se fijan al fondo en la zona seleccionada, donde eventualmente generan su órgano de fijación adhiriéndose al sustrato. Para el traslado de las frondas al Sistema Suspendido, se retiraron cuidadosamente los ejemplares del bastidor y por medio de un encordado, los discos de fijación del alga se atan entrelazadas en una cuerda de nylon de 1.8 cm de diámetro sujeta en los extremos al sustrato.
Promedio de flujo de agua para el cultivo: Tanto en mar como en tierra, deben de contar con flujos de agua continuos que permitan el abastecimiento de los nutrimentos. La cantidad del flujo dependerá de la cantidad de nutrimentos que contenga el agua de abastecimiento, así como la densidad de los cultivos. Cuando los flujos son bajos, podrá considerarse la adición de fertilizantes.
Densidad de siembra: De 1500 a 2000 g /m2 en cultivos extensivos o de 2-3 kg en cultivos semi-intensivos.
Tamaño del organismo para siembra: Entre 15 a 20 cm en cultivos extensivos y de 5 a 15 en cultivos semi-intensivos.
Porcentaje de sobrevivencia: 100%.
Tiempo de cultivo: 30 a 60 días en cultivos extensivos y de 2 a 5 semanas en cultivos semi-intensivos.
Tamaño promedio de cosecha: de 25-35 cm de longitud en cultivos extensivos y de 5-7 kg por m3 en cultivos semi-intensivos.
VI. PIE DE CRÍA
Origen: La península de Baja California.
Procedencia: Praderas naturales de macroalgas.
VII. ALIMENTO
En laboratorio y estanques el aporte de nutrientes se realiza mediante la adición de fertilizantes agrícolas.
VIII. PARÁMETROS FÍSICO-QUÍMICOS
En las etapas de laboratorio y estanques, el pH entre 8.0 y 8.2; la densidad de flujo fotónico valores de 75 a 85 mol fotón m2. La salinidad fue de 28 a 33 y la temperatura de 11 a 13 ºC. El aporte de burbujeo mediante un soplador. Los recambios de agua en forma semanal (Zertuche-González, com.per.)
| PARÁMETRO | MÍN
| MÁX
|
| Temperatura (°C) | 11
| 18
|
| Salinidad (ups) | 26
| 36
|
| Oxígeno (mg/l) | > 7
|
| pH | 7.5
| 8.5
|
| Transparencia (m) | 2-10
|
IX. SANIDAD Y MANEJO
Importancia de la sanidad acuícola: Un manejo sanitario estricto de las instalaciones de cultivo, tomas y tratamiento de agua de alimentación, así como limpieza de las instalaciones de laboratorio en todos los procesos implicados, evitará la aparición de enfermedades en las cepas destinadas al cultivo así como la proliferación de fauna nociva.
Enfermedades reportadas: No se han reportado enfermedades en este recurso, sin embargo, si hay riesgo de acumulación excesiva de biomasa algal, que, de no manejarse apropiadamente, puede originar arribazones masivas y crear condiciones anóxicas en cuerpos de agua con poca circulación y afectar a la fauna circundante.
Buenas prácticas de producción acuícola: Establecer instalaciones para el filtrado y tratamiento de las aguas de alimentación con luz ultravioleta, de igual manera tratar las aguas de descarte para evitar florecimientos algales sin control; además establecer unidades de cuarentena para los organismos a cultivar, evitando con ello la proliferación de fauna nociva.
X. MERCADO
Presentación del producto: Cuando el propósito es emplearlas como alimento en organismos en cultivo, al ser cosechadas, son trasladadas frescas directamente a los centros de consumo; por otra parte, si se van a aprovechar como materias primas para procesos como la producción de agar, alimentos balanceados, etc., donde los centros de aprovechamiento se encuentran lejos de la zona de producción, se requiere un tratamiento para su conservación y transporte, en este caso la deshidratación al sol y embalado en pacas de 80 a 100 kg es la mejor opción.
Precios del producto: El precio del producto, dependerá de la aplicación a la que se destina; si la aplicación es para consumo directo en granjas de cultivo, no implica el secado, su precio estará entre $1 a $3 MXN/kilo fresco; mientras que si es como materia prima para la obtención de agar estaría en el intervalo de $15 a $20,000 MXN/tonelada seca.
Mercado del producto: Debido al éxito que tiene el cultivo de Gracilaria spp. en países como Chile, el mercado internacional es muy competitivo.
XI. INFORMACIÓN Y TRÁMITES
I. CONAPESCA: www.gob.mx/conapesca
II. SENASICA: www.gob.mx/senasica
III. SEMARNAT: www.gob.mx/semarnat
IV. CONAGUA: www.gob.mx/conagua
V. SEMAR: www.gob.mx/semar
XII. NORMATIVIDAD
Para esta especie no se cuenta con ninguna normatividad específica, para normatividad general consultar anexo.
XIII. MANEJO ECOSISTÉMICO
I. Mantener las praderas silvestres en buen estado con colectas en las épocas de mayor crecimiento para evitar desprendimientos y arribazones excesivos.
II. La creación de cultivos en diferentes zonas promoverá la formación de hábitat nuevo favoreciendo el desarrollo de comunidades marinas.
III. En diferentes localidades costeras, promover cultivos multitróficos integrados con especies de alto valor comercial siendo con ello fuentes de nuevos empleos.
IV. Desarrollar un plan de manejo acuícola para esta especie.
V. Se requiere tomar acciones transversales para la pesca y acuacultura para el fortalecimiento de los bancos pesqueros e impulso de la competitividad.
XIV. INVESTIGACIÓN Y BIOTECNOLOGÍA
Desarrollo tecnológico:
I. Selección de cepas que proporcionen mejores crecimientos y, mejores rendimientos y calidades de agar.
II. Control total de los ciclos reproductivos generando en laboratorio las esporas e inoculando en materiales que posteriormente se plantan en la zona seleccionada.
III. Implementar programas de mejoramiento genético seleccionando organismos con mayor tolerancia a los cambios ambientales, mejores tasas de crecimiento, mejor contenido nutrimental y o mejores características de agar.
IV. Fomentar cultivos multitróficos que incluyan algas marinas a gran escala y organismos que las utilicen como alimento y que a su vez las algas marinas aprovecharan las excretas generadas, evitando con ello la eutroficación de las aguas.
Sanidad: Identificar zonas costeras libres de descargas antropogénicas, que pudieran provocar una carga bacteriana excesiva o la presencia de metales pesados.
Comercialización: Buscar mercados alternos a mediano plazo, incorporarlo como alimento en los cultivos comerciales de abulón y otros organismos marinos en cultivo; de igual manera buscar mercado como complemento en forrajes para uso animal; desarrollar nuevas aplicaciones acordes a nuestros usos y costumbres. Explorar el mercado asiático.
Tecnología de alimentos: Desarrollar o adaptar aplicaciones del agar de Gracilaria en alimentos, tales como gelatinas, jaleas, ates y mermeladas entre otros.
XV. EFECTOS AMBIENTALES Y CAMBIO CLIMÁTICO
Como consecuencia de los efectos del cambio climático, seleccionar áreas que mantengan condiciones de cultivo estables y las siguientes consideraciones:
I. Los cambios en la distribución, en la composición de las especies y en los hábitats, provocarán modificaciones en las prácticas acuícolas, en donde se reubicarán las instalaciones.
II. Mejorar la selección de cepas para conseguir la tolerancia a temperaturas más altas, mejor contenido nutricional y mejores características de su agar.
III. Mejorar la planificación y el emplazamiento de las instalaciones, ajuste al cambio climático.
XVI. ESTADÍSTICAS DE PRODUCCIÓN
No hay registros de producción.
3.3 Jaiba azul
I. GENERALIDADES
Nombre común: Jaiba azul y Jaiba guerrera.
Nombre científico: Callinectes sapidus Rathbun, 1896 y Callinectes bellicosus Stimpson, 1859, respectivamente.
Nivel de dominio de la biotecnología: Parcial, se controla una etapa de la vida de la jaiba sin embargo, por ser una técnica donde la materia prima utilizada se basa principalmente en hembras inmaduras, provoca que la población se vea mermada, con gran rapidez. Para ello se han realizado ensayos experimentales para la producción de algunas de estas etapas larvales.
Origen: C. sapidus es nativa de América desde Nueva Escocia, Canadá, hasta el norte de Argentina. En México se distribuye de Tamaulipas a Campeche y con menor incidencia en Yucatán y Quintana Roo. Por otro lado C. bellicosus se distribuye de California en EUA a Chiapas en México.
Estatus del cultivo: Solo para producir jaiba suave en sistemas abiertos o cerrados, la producción de larvas de jaiba está en nivel experimental, tanto en el litoral del Golfo de México como en el Pacifico mexicano.
Mercado: Nacional e internacional principalmente EUA y Asia.
Limitantes técnico-biológicas de la actividad: El canibalismo es uno de los factores que limitan el desarrollo del cultivo de ciclo completo para este género.
II. ENTIDADES DE CULTIVO
En la actualidad no existen granjas con cultivo, aunque históricamente se realizaron pruebas en Veracruz, Tamaulipas y Campeche para C. sapidus: y en Sonora, Sinaloa y Baja California Sur para C. bellicosus.
III. ANTECEDENTES DE LA ACTIVIDAD
La técnica para la obtención de jaiba suave es una biotecnia de semiactivo que se inicia a mediados del siglo XIX en la costa Este de EUA y al paso del tiempo se hacen modificaciones hasta obtener sistemas abierto y cerrado. Esta técnica se implementa en México a partir de los años 80s por la Universidad Autónoma Veracruzana (UAV) y se va perfeccionando, hasta los años 90s donde Campeche y Tamaulipas tienen su desarrollo a nivel industrial, para incluso llevarlo a la exportación, esta técnica se aplicó en el Pacífico mexicano en los estados de Sonora, Sinaloa y Baja California Sur a partir del 2000.
Por otro lado, en Taiwán se logró obtener la larva megalopa en cautiverio, pero la producción no fue rentable dado que fue costosa, se requirió una gran superficie para su desarrollo a nivel adulto y mostró un alto índice de canibalismo. En México en el año 2002 se realizó a nivel experimental un ensayo para la obtención de larvas hasta la etapa de megalopa en la isla de Carmen, Campeche, y en la Universidad Autónoma del Carmen con el apoyo de la empresa MOLZA SA de CV y el CINVESTAV Unidad Mérida, pero aún no se logra llevar la tecnología hasta la obtención de ejemplares adultos y tampoco a nivel comercial, al igual que Taiwán el alto porcentaje de canibalismo deja de ser atractivo para productores.
IV. INFORMACIÓN BIOLÓGICA
Distribución geográfica: C. sapidus se encuentra desde Nueva Escocia, Canadá, hasta el Norte de Argentina, en México se distribuye en toda la costa del golfo de México, desde 2014 se han localizado ejemplares de esta especie en Europa y Asia. Por otro lado C. bellicosus se distribuye de California en EUA a Chiapas en México.
Morfología: Son crustáceos del género Callinectes de la familia Portunidae de cuerpo oval cuya característica principal es que presentan un exoesqueleto calcáreo, deprimido dorsoventralmente con dos espinas laterales, que arbitrariamente los científicos las toman para estimar la talla en el largo del caparazón y en la frente presentan varios dientes que son utilizados para determinar la clasificación de este grupo de crustáceos, Tienen 5 pares de patas, el primero modificado como tenazas que le sirven para pescar y desgarrar sus alimentos, 3 pares de patas que son utilizadas para su desplazamiento en tierra y 2 pares de patas modificados como aletas, para su desplazamiento acuático.
Ciclo de vida: Consta de tres etapas: la etapa reproductiva inicia aproximadamente a los 268 días de haber eclosionado, presenta dimorfismo sexual en el abdomen, los machos tiene un abdomen con forma de una "T" invertida, mientras que las hembras su abdomen es semicircular, en el caso de las hembras maduras y además presentan en su edad inmadura un abdomen de forma triangular, que se modifica al pasar a la etapa adulta, en la última muda (ecdisis l), la tallas de madurez sexual, varía desde los 80 a los 150 mm de caparazón (medido de espina a espina). Durante la última muda como hembra inmadura, el macho la protege durante los últimos 8 días hasta que logra salir completamente del caparazón, para poder fecundarla y le deja depositado en el ovario el espermatóforo, mismo que la hembra hará viable cuando las condiciones de clima, salinidad y alimentación sean favorables para fecundar los óvulos. Una vez fecundados los huevos son depositados en su abdomen auxiliándose de sus pleópodos y forma una masa compacta, una hembra según su talla puede llegar a fecundar de 700 mil a 2 millones de huevecillos, a esa masa de hueva, se le denomina comúnmente como "esponja", la cual se tornará de amarilla a negra, según el avance de desarrollo del embrión dentro del huevo, que se logra a los 15 días.
Las hembras ovígeras se desplazan a las playas donde auxiliadas por el golpeteo de las olas se logra desprender los huevecillos de la esponja, el embrión eclosiona en un ambiente salino, como la playa marina, a partir de ese momento el desarrollo larvario se lleva a cabo en el mar y dura de 31 a 49 días pasando como todos los crustáceos, por 7 etapas de larva zoea, hasta que alcanza la etapa de larva megalopa, para sufrir una metamorfosis en la que involuciona el abdomen para dar origen a la jaiba I, que tiene en promedio un talla de 1 cm y durante los próximos 30 días pasará por varios periodos de muda o ecdisis hasta alcanzar los 4 cm, esta etapa ya la realiza en las tranquilas aguas de una laguna costera, en donde pasarán aproximadamente 300 días hasta alcanzar la madurez sexual, pasando aproximadamente por 52 ecdisis y así cerrar el ciclo.
Según las estimaciones de los expertos, de cada hueva producida solo el 10% de ella, llegará a la etapa adulta.
Hábitat: Organismos bentónicos, que habitan tanto en lagunas costeras, como en ambientes marinos y los machos tienen una preferencia por ambientes más dulceacuícolas como los ríos y esteros, lo que está regulado por una condición osmótica de su organismo, así que esta especie la podemos encontrar en ambientes con salinidad desde los 10 a los 35 ups de salinidad; son muy sensibles a las cambios de temperatura y difícilmente se encuentran ejemplares por debajo de los 13 °C; el Oxígeno disuelto en el agua, no es un factor determinante para su distribución así como tampoco lo es el intervalo del potencial de Hidrogeno del agua.
Alimentación en medio natural: Son organismos omnívoros, detritívoros, carroñeros y caníbales, sobre todo en cautiverio, se les denomina como organismos "altamente voraces", su alimentación está más bien regulada por su etapa ontogenética. La mayor parte de su vida la desarrollan en los mantos de vegetación sumergida como el pasto marino, también llamado "pasilla" ya que les proporciona refugio para el complejo sistema de crecimiento que presentan, como lo es los periodos constantes de ecdisis o muda, etapas en las que quedan totalmente frágiles y expuestas al ataque de sus depredadores.
V. CULTIVO - ENGORDA
Biotecnología: Sistema abierto en jaulas y/o cajas de madera y Sistema cerrado con tinas de fibra de vidrio y filtros mecánico y biológico para el control del amoniaco.
Sistemas de cultivo: Sistema abierto se colocan en el medio natural tinas de madera o jaulas de madera y malla plástica que se unen unas a otras para poder controlar la producción, solo se colocan las jaibas capturadas en el medio natural y clasificadas detalladamente para ser depositadas en las cajas/jaulas y se revisan hasta 4 veces al día, para extraer las que hayan mudado, los exoesqueletos, es una técnica muy sencilla y rudimentaria, con muy altos índices de mortalidad y bajo rendimiento económico.
El sistema cerrado se lleva a cabo en cobertizos en los cuales se colocan más de 20 tinas de fibra de vidrio con dimensiones de 250 x 125 x 0.40 m c/u, a las cuales mediante un sistema de filtros mecánico y biológico se recicla el agua marina que mantendrá a las jaibas por un tiempo promedio de 3 a 5 días en el sistema, durante el proceso de muda estos ejemplares dejan de alimentarse, por ello no se les suministra alimento, sin embargo y debido al proceso hormonal al que están sujetas durante la ecdisis, liberan altas concentraciones de amoniaco, por ello es importante llevar un meticuloso control del sistema de filtros.
El filtro mecánico conformado por piedra de rio ayuda a retener todo tipo de materia orgánica y el filtro biológico al cual se le debe sembrar colonias de bacterias nitrificantes, las cuales realizarán la función de desdoblar el amoniaco, para evitar que la producción muera por intoxicación, así el ciclo del nitrógeno en el sistema pasará de Amoniaco (NH4)- Nitritos (NO2)- Nitrato (NO3-)- Nitrógeno (N orgánico).
Solo el 7% de la captura de jaiba en la zona puede ser considerada como materia prima para una planta de la producción de jaiba suave, la cual una vez aclimatada en el sistema se debe clasificar para evitar el canibalismo propio de estos ejemplares, la clasificación se basa en un 80% en ejemplares de hembras inmaduras, en las cuales se facilita la clasificación, debido a que según el grado de avance de la ecdisis (muda) presenta cambios en la coloración tanto del abdomen, que va cambiando de color crema a rojo obscuro, lo mismo sucede con las aletas natatorias que al irse despegando el nuevo caparazón del inicial se forma una línea que cambia de color conforma avanza el estadio de la muda y se clasifica así:
I. Blanco (intermuda tardará de 15 a 10 días para iniciar la muda);
II. Verde premuda inicial (de 10 días);
III. Rosa de 5 a 3 días y;
IV. Rojo de 3 a 1 día.
Es muy importante que la clasificación se realice en base a este avance de la muda, de lo contrario los ejemplares más retrasados en la muda se comerán a las que ya mudaron. Una vez afuera del caparazón se deben mantener en un anillo al menos 20 minutos para que se forme lo que se denomina como "caparazón de papel", el cual les dé un mejor tiempo de anaquel y presentación a la hora de ser cocinadas.
Características de la zona de cultivo: Para el sistema abierto se puede utilizar cualquier estero tranquilo y de fácil acceso, para facilitar la supervisión y control de los organismos en premuda.
El sistema cerrado puede ser implementado en cualquier domicilio, que es lo que lo hace un sistema muy atractivo para el productor, o en una instalación industrial, ya que el agua que se utiliza es artificial y se prepara a partir de sal marina comercial y agua de pozo, sin cloro, y ello facilita el manejo.
Artes de cultivo: Sistema abierto cajas de madera o jaulas de malla de plástico rígido con dimensiones de 250 x 125 x 0.60 m que son aseguradas a un muelle y se amarran unas con otras para su fácil control y revisión.
En cuanto al sistema cerrado las tinas que se utilizan son de fibra de vidrio con las mismas medidas aunque la profundidad es de 40 cm, una red de drenaje construido con tubería de PVC, y una red de suministro del flujo de agua que procede de los filtros mecánico y biológico. En este sistema lo más importante es la limpieza y mantenimiento de la colonia de bacterias nitrificantes, para evitar la toxicidad del agua.
Promedio de flujo de agua para el cultivo: Solo para el sistema cerrado este flujo debe ser de 18 L/min. Cada tina contiene un volumen de 312 L. Y el recambio total se realiza cada 3 horas en cada tina.
Densidad de siembra: La bibliografía recomienda 300 jaibas por tina (2.50 x 1.25 x 0.40 m), sin embargo, se ha visto que la mortalidad se reduce considerablemente si solo se colocan 200 por tina.
Tamaño del organismo para siembra: De 50 a 120 mm de caparazón (tomada de espina a espina).
Porcentaje de sobrevivencia: Dependiendo el nivel de premuda de los ejemplares tendremos que los ejemplares con línea verde presentan una sobrevivencia del 65%, los ejemplares con línea rosa presentan una sobrevivencia del 70%.
Tiempo de cultivo: De 1 a 10 días.
Tamaño promedio de cosecha: En una instalación de 20 tinas tenemos un promedio de 21 docenas/día.
VI. PIE DE CRÍA
Origen: Nacional
Procedencia: Del medio natural.
VII. ALIMENTO
Sin suministro de alimento.
VIII. PARÁMETROS FÍSICO-QUÍMICOS
| PARÁMETRO FÍSICO-QUÍMICO
| INTERVALO
|
| Temperatura del agua (°C)
| 17-30
|
| Salinidad (ups)
| 5-29
|
| Oxígeno disuelto (mg/L)
| 7
|
| pH
| 7-8
|
| Amoniaco (mg/L)
| 0
|
| Nitritos (mg/L)
| 0
|
| Nitratos (mg/L)
| 0.5
|
IX. SANIDAD Y MANEJO
Importancia de la sanidad acuícola: Si se lleva un adecuado control de siembra, por cada etapa solo se requiere evitar la mortalidad por canibalismo, quizá mediante anillos de PVC que protejan a las jaibas mudadas mientras forman el caparazón de "papel" (caparazón de papel se le denomina a los primeros momentos después de la muda en que el nuevo caparazón se inicia el recubrimiento de carbonato de calcio, el cual es tan delgado como un papel, de ahí su nombre).
Enfermedades reportadas: En caso de que se presente un corte en el suministro de la energía eléctrica, es fundamental vaciar las tinas, pues de lo contrario las jaibas tienen el riesgo de morir por asfixia, son organismos que pueden sobrevivir. Pero el tiempo que permanecerán las jaibas en el sistema es tan corto (máximo 10 días) que hasta la fecha no se tiene registro de mortalidad por enfermedad.
Buenas prácticas de producción acuícola: Clasificación meticulosa de los ejemplares que se introducirán en el sistema. Existe mucha bibliografía tanto Internacional como Nacional.
X. MERCADO
Presentación del producto: La jaiba suave se comercializa con caparazón de "papel" fresca y/o congelada, entera o eviscerada y por tallas y en cajas que pueden contener 1 o 2 docenas.
Precios del producto: Se vende por caja con 1 o 2 docenas y es en función de la talla:
| CLASIFICACIÓN
| TALLA (mm)
| PESO (gr)
| PRECIO (USD)
|
| Primera | 80-100 | 50
| 60.00
|
| Media | 101-125 | 60
| 66.00
|
| Hotel | 126-145 | 80
| 70.00
|
| Jumbo | 146-165 | 100
| 90.00
|
| Ballena | Más de 166 | 120
| 127.00
|
Mercado del producto: EUA, Asia y Europa, en México solo se comercializa localmente donde se encuentran las plantas productoras.
XI. INFORMACIÓN Y TRÁMITES
I. SEMARNAT: www.gob.mx/semarnat
II. CONAPESCA: www.gob.mx/conapesca
III. SENASICA: www.gob.mx/senasica
IV. CONAGUA: www.gob.mx/conagua
XII. NORMATIVIDAD
Específica para la especie:
NORMA Oficial Mexicana NOM-039-PESC-2003, Pesca responsable de jaiba en aguas de jurisdicción federal del litoral del Océano Pacífico. Especificaciones para su aprovechamiento.
NORMA Oficial Mexicana NOM-009-PESC-1993, Que establece el procedimiento para determinar las épocas y zonas de veda para la captura de las diferentes especies de la flora y fauna acuáticas, en aguas de jurisdicción federal de los Estados Unidos Mexicanos.
Para normatividad general revisar anexo.
XIII. MANEJO ECOSISTÉMICO
Requeridas para proteger al recurso jaiba.
| ETAPA
| SITUACIÓN
| COMO
|
| Larvas | Los drenajes domésticos e industriales se vierten a los cuerpos de agua. | Plantas de tratamiento de aguas municipal e industrial. |
| Cultivo de larvas, megalopas y primera jaiba | Una acuacultura extensiva podía auxiliar a mantener la población adulta de jaiba en los ecosistemas. | Produciendo grandes volúmenes megalopas y/o primera jaiba, que fueran liberadas en los embalses salobres. |
| Juveniles | Se autoriza usar redes de arrastre en las lagunas costeras, que arranca los pastizales marinos y en las jaibas quedan vulnerables durante el periodo de mudas. | Educación a los permisionarios, decomiso, multa y retiro de permiso si no respetan la Ley General de Pesca y Acuacultura Sustentables |
XIV. INVESTIGACIÓN Y BIOTECNOLOGÍA
Desarrollo tecnológico: Incipiente para la producción de larvas y megalopas, aún no se hace a nivel comercial.
Sanidad: El diseño tecnológico en las plantas de producción de jaiba suave, se centra en el mejoramiento de los filtros en diseño y materiales, ya que el mal funcionamiento de un filtro, puede causar altos niveles de mortalidad.
XV. EFECTOS AMBIENTALES Y CAMBIO CLIMÁTICO
Desde el 2014 se tienen registros de una invasión de jaiba azul gigante en el Mediterráneo, los investigadores de la Universidad de Valencia señalan al cambio climático a esta invasión.
Uno de los factores que a lo largo de la vida de la jaiba modifica sus hábitos es la temperatura y el cambio climático ha modificado en el planeta este factor, con intervalos que van de más de 15 grados tanto al alza como a la baja.
Estos crustáceos son altamente sensibles a las bajas temperaturas, en zonas subtropicales un cambio de por debajo de los 17 o por arriba de los 30 °C causa en la población de la jaiba cambios en su desarrollo de reproducción, alimentación y crecimiento.
XVI. ESTADÍSTICAS DE PRODUCCIÓN
Según datos de anuarios estadísticos de CONAPESCA en el año de 2005 existió una producción de 432 kg proveniente de Veracruz sin embargo no hay reportes de cultivo desde entonces.
3.4 Medusa bola de cañón
I. GENERALIDADES
Nombre común: Medusa bola de cañón.
Nombre científico: Stomolophus meleagris L. Agassiz, 1860.
Nivel de dominio de la biotecnología: Incompleta o parcial.
Origen: Especie que habita a ambos lados de las costas mexicanas, tanto en el Golfo de México y Mar Caribe, como en el Océano Pacífico, incluyendo Golfo de California.
Estatus del cultivo: Experimental y de ornato.
Mercado: Nacional para ornato e Internacional para consumo humano.
Limitantes técnico-biológicas de la actividad: Escalamiento de cultivos de pólipos a nivel comercial, diseño de estrategias de engorda para juveniles más allá de los 10 mm, desarrollo de sistemas de maricultivo y experimentación con repoblamiento.
II. ENTIDADES DE CULTIVO
Actualmente se realiza de manera ornamental o experimental en los estados de Baja California Sur, Veracruz, Sonora, Querétaro, Quintana Roo y Ciudad de México.
III. ANTECEDENTES DE LA ACTIVIDAD
El cultivo de medusa bola de cañón se realiza desde 2006 con fines principalmente experimentales y para exhibición en acuarios. El cultivo experimental se ha llevado a cabo regularmente en las instalaciones del Centro de Investigaciones Biológicas del Noroeste para la producción y mantenimiento de organismos en fase polipoide y obtención de estadios medusoides tempranos, para investigar su fisiología y desarrollo ontogénico, mientras que en acuarios de diversos estados del país (Veracruz, Querétaro, Quintana Roo, Ciudad de México) mantienen organismos silvestres de esta especie, para exhibiciones públicas. Actualmente se considera que el desarrollo de esta tecnología cuenta con un gran potencial, para llevar a cabo el repoblamiento de cuerpos de agua costeros que han sido sobreexplotados, o que por alguna causa no antropogénica se hayan desplazado o mermado las poblaciones naturales.
En la actualidad existen al menos dos laboratorios que cuentan con poblaciones constantes de S. meleagris en fase polipoide, en el CIBNOR La Paz, B.C.S. y Guaymas, Son., los cuales cuentan con capacidad para producir pólipos y estadios juveniles tempranos de medusa en baja escala para investigación científica.
Para lograr el cultivo de S. meleagris, es necesario desarrollar técnicas de escalamiento (primero a nivel piloto experimental y después a nivel piloto comercial) en la producción de pólipos, e investigar los sustratos y alimentación idóneos para el asentamiento de pólipos. Así mismo, es necesario investigar aspectos nutricionales (tanto con alimento vivo como fórmulas nutricionales preparadas), así como sistemas de cultivo, tanto para optimizar la producción de reclutas por estrobilación y la engorda de éfiras, juveniles y adultos.
Para la etapa final de cultivo, es necesario diseñar metodologías de cosecha de juveniles cultivados para su extracción, traslado y siembra en sistemas de maricultivo o sistemas abiertos (repoblamiento) para la etapa de engorda hasta alcanzar la talla comercial.
Aunque mundialmente la medusa bola de cañón capturada en México tiene mercado establecido y es generalmente bien aceptada por su textura crujiente y tamaño relativamente grande, existen algunos fenotipos de esta especie que presentan cualidades superiores en tamaño, textura y color, algunas de las cuales se ubican en el Golfo de México y Alto Golfo de California.
Debido a lo anterior surge la necesidad de desarrollar líneas filogenéticas de S. meleagris que mantengan o mejoren las cualidades que ya presenta la especie de manera natural (fomentado el cultivo del fenotipo blanco), ya sea mediante selección artificial o técnicas de ingeniería genética, lo cual aún exige una importante inversión de tiempo y recursos en investigación básica y aplicada. Sin embargo, se estima que, dada la importancia biológica, ecológica y económica de la especie, así como su potencial de desarrollo acuícola, dicha inversión estaría bien justificada.
IV. INFORMACIÓN BIOLÓGICA
Distribución geográfica: Se han reportado medusa bola de cañón desde Nueva Inglaterra hasta Argentina en el Atlántico occidental y desde el sur de California hasta Ecuador en el Pacífico oriental. Son una de las especies de escifomedusas más abundantes de la zona costera americana, llegando a formar enjambres superficiales integrados por millones de organismos.
Morfología: En la naturaleza se le puede encontrar simultáneamente en dos estados morfológicos: La forma polipoide y la forma medusoide.
Como pólipo, la especie es sésil, de tamaño generalmente menor a 5 mm. Se compone de un tronco central con forma de cáliz, unido al sustrato mediante un disco pedal quitinoso y terminado en un orificio bucal central flexible en todas direcciones, el cual está rodeado por 8 tentáculos elásticos con movilidad independiente entre sí.
Como medusa, la especie es de hábitos pelágicos. Se distingue fácilmente en el mar, ya que llegan a medir entre 100 y 200 mm de longitud/diámetro en estadio adulto. Se caracteriza por su forma de semiesfera u "hongo gigante", cuyo perfil puede observarse nadando mediante pulsos relativamente lentos cerca de la superficie, generalmente en la franja costera o dentro de bahías y lagunas costeras someras. Anatómicamente consisten en una cubierta superior con forma de campana semiesférica o umbrela que envuelve un tronco central rugoso o piñón, el cual se une a la campana mediante 4 ligamentos gelatinosos y formando una cavidad o coelenterón entre el tronco y la umbrela.
Ciclo de vida: Stomolophus meleagris tiene un ciclo metagenético con alternancia entre la fase polipoide y la fase medusoide. La fase medusa es dioica con fecundación externa, de cuyo producto resulta una larva aplanada, ciliada y periforme denominada plánula las cuales nada libremente en el plancton hasta que se asientan en un sustrato fijo, donde pasan por varias etapas de metamorfosis hasta convertirse en un pólipo. Durante las fases de pólipo, S. meleagris se puede reproducir por varias vías asexuales, incluyendo quistes pedales o podocistos, fisión, laceración pedal, gemación y estrobilación. Esta última modalidad consiste en la formación de múltiples discos o coronas apicales, las cuales, al desarrollarse comienzan a presentar movimientos propios hasta que terminan por liberarse del pólipo madre. Cada segmento liberado se denomina éfira y se desarrollarán hasta convertirse en medusas, reiniciando así el ciclo de vida de S. meleagris. Cabe mencionar que la fase de medusa tiene un periodo de vida de alrededor de 6 a 7 meses y presentan mortandades masivas al final de su periodo reproductivo, mientras que estadio polipoide puede perdurar por años y replicarse asexualmente de manera intermitente durante todo el año.
Hábitat: Son organismos de distribución costera-nerítica y superficial, generalmente asociados a aguas marinas someras cercanas o dentro de bahías y lagunas costeras areno-limosas. Durante su periodo reproductivo es común observarlas formando grandes franjas o parches de medusas en cantidades del orden de los millones de individuos, agregadas cerca de la zona de rompientes, a pocos metros de la orilla del mar. Debido a que su nado es relativamente lento y errático, se les considera planctónicas, aunque pueden llegar a migrar grandes distancias.
Alimentación en medio natural: Son animales planctívoros y principalmente ovífago. Aunque son capaces de consumir decenas de ítems alimenticios del zooplancton, presentan una marcada preferencia por huevos de peces, copépodos, larvas de moluscos, cirripedios y decápodos, así como apendicularios. Debido a que carece de tentáculos funcionales, se alimenta mediante la filtración del agua que succiona y expele durante el nado, por lo que se le considera un depredador de crucero.
V. CULTIVO - ENGORDA
Biotecnología: Incompleta. Se utiliza principalmente Artemia sp. en forma de quistes descapsulados y nauplios, además de filtrados no específicos de zooplancton.
Sistemas de cultivo: Para exhibición se utilizan sistemas tipo Kreisel. Probablemente el sistema de producción masiva más adecuado para el cultivo de medusa bola de cañón sea la modalidad de maricultivo, o bien cultivo de estadios tempranos destinados al repoblamiento.
Características de la zona de cultivo: Zona costera protegida, somera y con altos niveles de producción secundaria.
Artes de cultivo: No se ha determinado.
Promedio de flujo de agua para el cultivo: No se ha determinado.
Densidad de siembra: No se ha determinado.
Tamaño del organismo para siembra: 5 a 10 mm aproximadamente.
Porcentaje de sobrevivencia: No se ha determinado.
Tiempo de cultivo: Permanente para pólipos y de 3 a 4 meses para engorda.
Tamaño promedio de cosecha: A partir de 100 mm.
VI. PIE DE CRÍA
Origen: Nacional.
Procedencia: Golfo de California. Laboratorios del Centro de Investigaciones Biológicas del Noroeste, campus La Paz, BCS y Guaymas, Sonora.
VII. ALIMENTO
Artemia sp. en forma de quistes descapsulados y nauplios, además de biomasa no específica de zooplancton.
VIII. PARÁMETROS FÍSICO-QUÍMICOS
| PARÁMETRO
| INTERVALO ÓPTIMO
|
| Salinidad (ups)
| 30 a 35
|
| pH
| |
| Temperatura (°C)
| 21 a 25
|
| Oxígeno disuelto (mg/L)
| > 3
|
IX. SANIDAD Y MANEJO
Importancia de la sanidad acuícola: No hay información sobre posibles problemas sanitarios durante la fase de cultivo ni se han definido metodologías específicas para este recurso.
Enfermedades reportadas: No hay enfermedades reportadas a la fecha, sin embargo, se sabe que las medusas pueden ser parasitadas por cirrípedos, isópodos y parásitos de gónadas no identificados.
Buenas prácticas de producción acuícola: No se ha elaborado un manual para esta especie.
X. MERCADO
Presentación del producto: Vivas para exhibición y en conserva saladas-deshidratadas para consumo humano.
Precios del producto: Desde $ 1,500.00 USD a $ 6,000.00 USD por tonelada de producto salado-deshidratado para consumo humano, aproximadamente. Se desconoce el precio en que se venden vivas para exhibición.
Mercado del producto: Productos en conserva de consumo humano para el mercado asiático, principalmente China y Japón. Especímenes vivos para acuarios nacionales.
XI. INFORMACIÓN Y TRÁMITES
I. SEMARNAT: www.gob.mx/semarnat
II. CONAPESCA: www.gob.mx/conapesca
III. SENASICA: www.gob.mx/senasica
IV. SEMAR: https://www.gob.mx/semar
V. COFEPRIS https://www.gob.mx/cofepris
XII. NORMATIVIDAD
Para esta especie no se cuenta con ninguna normatividad específica, para normatividad general consultar anexo.
XIII. MANEJO ECOSISTÉMICO
Elaborar un padrón de productores, importadores y comercializadores.
XIV. INVESTIGACIÓN Y BIOTECNOLOGÍA
Desarrollo tecnológico: Desarrollo de técnicas de escalamiento (primero a nivel piloto experimental y después a nivel piloto comercial) en la producción de pólipos, e investigar los sustratos y alimentación idóneos para el asentamiento de pólipos. Es necesario investigar aspectos nutricionales (tanto con alimento vivo como fórmulas nutricionales preparadas), así como sistemas de cultivo, tanto para optimizar la producción de reclutas por estrobilación y la engorda de éfiras, juveniles y adultos.
Para la etapa final de cultivo, es necesario diseñar metodologías de cosecha de juveniles cultivados para su extracción, traslado y siembra en sistemas de maricultivo o sistemas abiertos (repoblamiento) para la etapa de engorda hasta alcanzar la talla comercial.
Sanidad: Determinación de probables patógenos y parásitos que afecten a la medusa. Es necesario determinar factores estresantes de la especie en condiciones de cultivo.
Comercialización: Realización de estudios de mercado y campañas informativas sobre los productos obtenidos mediante la producción acuícola de medusa.
Tecnología de alimentos: Elaboración de productos de valor agregado en función de los mercados de destinos. Diversificar clientes potenciales y establecimiento de estándares de calidad acordes al nicho de mercado a explotar.
Biotecnología: Extracción de ingredientes activos con potenciales aplicaciones en la medicina y cosmetología.
XV. EFECTOS AMBIENTALES Y CAMBIO CLIMÁTICO
No se han identificado efectos del cambio climático en el estado actual del cultivo de medusa, sin embargo, existe información de que altas temperaturas (condiciones El Niño), favorecen al crecimiento de la medusa.
XVI. ESTADÍSTICAS DE PRODUCCIÓN
No hay registros de producción.
3.5 Palma de mar
I. GENERALIDADES
Nombre común: Palma de Mar.
Nombre científico: Eisenia arborea (Areschoug). Una revisión reciente de la taxonomía de esta especie la ubica como sinónimo de Ecklonia arborea (Areschoug) M.D.Rothman, Mattio & J.J.Bolton, 2015.
Nivel de dominio de la biotecnología: Completo.
Origen: Eisenia arborea es un recurso ampliamente distribuido Baja California, particularmente su límite sur se ubica en la región de Bahía Asunción en BCS, donde no llegan otras especies como Macrocystis sp.
Estatus del cultivo: Experimental.
Mercado: Consumo nacional.
Limitantes técnico-biológicas de la actividad: La posibilidad de desarrollar cultivos dependerá de poder controlar su crecimiento, reproducción y ciclo de vida.
II. ENTIDADES DE CULTIVO
Baja California y Baja California Sur.
III. ANTECEDENTES DE LA ACTIVIDAD
Ecklonia arborea (Areschoug) M.D.Rothman, Mattio & J.J.Bolton (antes Eisenia arborea (Arechoug)), esta es una especie de alga parda, que forma grandes praderas submareales y ampliamente distribuida en la costa del Pacífico de Baja California. Igual que el recurso Macrocystis pyrifera, sus poblaciones se asocian positivamente a pesquerías de alto valor comercial como abulón, erizo de mar y langosta entre otros, que utilizan los bosques de macroalgas como alimentación y o refugio en diferentes etapas de su vida. El historial de uso de esta especie, se restringe a la elaboración de harinas para alimento humano; sin embargo, en Baja California Sur no se permite su extracción ya que se considera que es el principal alimento del abulón. Investigadores del Instituto de Investigaciones Oceanológicas (IIO-UABC), cuentan con biotecnia de cultivo de esta y otras especies de macroalgas.
IV. INFORMACIÓN BIOLÓGICA
Distribución geográfica: La distribución de esta especie en México ha sido descrita de manera continua a lo largo de la península de Baja California desde la frontera con Estados Unidos (Baja California) hasta la isla Santa Margarita en Baja California Sur (24º26'N, 111º49'O) (Druehl 1970).
Morfología: Es una planta perenne que se desarrolla en el submareal con fondos rocosos, principalmente en zonas de alta energía; se fija con una fuerte estructura densamente ramificada o rizoide, de este se desprenden un estipe grueso que puede alcanzar una altura de hasta 1.5 m, termina en la parte superior con una bifurcación u horqueta en cuyo extremo se encuentra una estructura carnosa donde se desprende una serie de hojas o esporofilos (láminas que producen esporas) que incrementan en tamaño hacia el centro. Las plantas esporofitas adultas (desde 40 cm) generalmente poseen hojas corrugadas con bordes dentados (Druehl, 2000), plantas que crecen en zonas más expuestas poseen hojas más lisas. A diferencia de las plantas adultas, las juveniles presentan una morfología muy diferente, que pudiera confundirse con otra especie, ya que carecen del estipe distintivo, del rizoide se desprende un estipe delgado sobre el cual se desarrolla una sola hoja con numerosas elongaciones laterales.
Ciclo de vida: El orden laminariales al que pertenece E. arborea posee un ciclo de vida donde hay alternancia de generaciones esporofito-gametofito (Bold y MJ. Wynne. 1985); es un ciclo de vida heteromorfo, donde las plantas gametofitas son plantas microscópicas, mientras que las plantas esporofitas son macroscópicas. La planta esporofita (macroscópica) poseen las estructuras reproductivas (zoesporangios) en láminas especializadas que se encuentran en la base de la planta, estas estructuras, eventualmente liberan las zooesporas (n) dando lugar a las plantas gametofitas (n) hembra o macho (microscópicas), las cuales participan en la fecundación (zigoto 2n) que da lugar a la planta esporofita macroscópica esporofito (2n).
Hábitat: Crecen en los márgenes de los océanos, principalmente en las zonas más expuestas al oleaje, verticalmente se distribuye en el submareal, pero también se encuentra en el intermareal medio-bajo (Abbott & Hollenberg 1976).
Alimentación en medio natural: Estos organismos aprovechan la luz solar para realización de la fotosíntesis, que es la base para la formación de materia orgánica y los nutrimentos tales como nitrógeno, fósforo, carbono entre otros, los toman como compuestos inorgánicos directamente de las aguas en que se desarrollan.
V. CULTIVO - ENGORDA
Biotecnología: Se cuenta con la biotecnología completa para el cultivo de esta especie. El material reproductivo (esporofilos), se colectan directamente de plantas que crecen en el medio natural, se transportan en hieleras (sin agua) al laboratorio donde son lavadas y cepilladas con agua dulce y después con agua de mar; posteriormente se colocan trozos de esporofilos con soros en cámaras de inoculación con agua de mar filtrada y esterilizada con UV donde se encuentra una cuerda de nylon de aprox. 2 mm de diámetro sobre un tubo de PVC. Después de inoculadas las cuerdas, se dejan reposar de 24 a 48 horas en oscuridad total a temperaturas entre 10 y 12 °C. Posteriormente los tubos con la cuerda se colocan en tanques de cultivo con iluminados y aireación; se monitorea al microscopio el desarrollo de los gametofitos. Después de tres a cuatro semanas se comenzará a observar el crecimiento de los esporofitos juveniles los cuales pueden tener un periodo de aclimatación-crecimiento en tanques exteriores con suministro de aire, agua de mar circulante y suministro de nutrientes. Posteriormente cuando alcancen tallas entre 1 a 2 mm podrán trasladarse al mar.
Sistemas de cultivo: Se han realizado con éxito pruebas de cultivos multitróficos (Zertuche-González com. per).
Características de la zona de cultivo: Deben ser zonas con fondos rocosos, con corrientes moderadas, limpias y transparentes, libres de descargas antropogénicas.
Artes de cultivo: Va de acuerdo a las diferentes etapas de cultivo, en la etapa de inoculación se hace en cámaras a nivel laboratorio; posteriormente se usan tanques o piletas con agua corriente y burbujeo y a final de cuentas las cuerdas con los organismos esporofitos se fijan al fondo en la zona seleccionada, donde eventualmente generan su órgano de fijación adhiriéndose a las rocas.
Para el traslado de las frondas al Sistema Suspendido, se retiran cuidadosamente los ejemplares del bastidor y por medio de un encordado, la cuerda con los esporofitos se enrolla cuidadosamente a lo largo de la cuerda de nylon de 1.8 cm de diámetro. Las cuerdas se atan en sus extremos a peso muerto y para mantener la línea a profundidad constante se usan boyas distribuidas a lo largo de la cuerda.
Promedio de flujo de agua para el cultivo: Los cultivos de Ecklonia arborea, tanto en mar como en tierra, deben de contar con flujos de agua continuos que permitan el abastecimiento de los nutrimentos. La cantidad del flujo dependerá de la cantidad de nutrimentos que contenga el agua de abastecimiento, así como la densidad de los cultivos. Cuando los flujos son bajos, podrá considerarse la adición de fertilizantes.
Densidad de siembra: ND.
Tamaño del organismo para siembra: Entre 15 a 25 cm.
Porcentaje de sobrevivencia: ND.
Tiempo de cultivo: ND.
Tamaño promedio de cosecha: ND.
VI. PIE DE CRÍA
Origen: La península de Baja California.
Procedencia: Praderas naturales de macroalgas.
VII. ALIMENTO
En laboratorio y estanques el aporte de nutrientes se realiza mediante la adición de fertilizantes agrícolas.
VIII. PARÁMETROS FÍSICO-QUÍMICOS
En las etapas de laboratorio y estanques, el pH entre 8.0 y 8.2; la densidad de flujo fotónico valores de 75 a 85 mol fotón m. La salinidad fue de 28 a 33 y la temperatura de 11 a 13 º C. El aporte de burbujeo mediante un soplador. Los recambios de agua en forma semanal.
| PARÁMETRO | MÍN
| MÁX
|
| Temperatura (°C) | 11
| 20
|
| Salinidad (ups) | 30
| 36
|
| Oxígeno (mg/l) | > 7
|
| Ph | 7.5
| 8.5
|
| Transparencia (m) | 2-10
|
IX. SANIDAD Y MANEJO
Importancia de la sanidad acuícola: Un manejo sanitario estricto de las instalaciones de cultivo, tomas y tratamiento de agua de alimentación, así como limpieza de las instalaciones de laboratorio en todos los procesos implicados, evitará la aparición de enfermedades en las cepas destinadas al cultivo, así como la proliferación de fauna nociva.
Enfermedades reportadas: No se han reportado enfermedades en este recurso, sin embargo, si hay riesgo de acumulación excesiva de biomasa algal, que, de no manejarse apropiadamente, puede originar arribazones masivos en la costa o crear condiciones anóxicas en cuerpos de agua con poca circulación y afectar a la fauna circundante.
Buenas prácticas de producción acuícola: Establecer instalaciones para el filtrado y tratamiento de las aguas de alimentación con luz ultravioleta, de igual manera tratar las aguas de descarte para evitar florecimientos algales sin control; además establecer unidades de cuarentena para los organismos a cultivar, evitando con ello la proliferación de fauna nociva.
X. MERCADO
Presentación del producto: Cuando el propósito es emplearlas como alimento para organismos en cultivo o fertilizantes líquidos, al ser cosechadas, se trasladan frescas directamente a los centros de consumo; por otra parte, si se van a aprovechar como materias primas para procesos como alimentos balanceados, complementos alimenticios etc., donde los centros de aprovechamiento se encuentran lejos de la zona de producción, se requiere entonces un tratamiento para su conservación y transporte, en este caso la deshidratación al sol y embalado en pacas de 80 a 100 kg es la mejor opción. Otra presentación es deshidratada para consumo humano, donde solo se utilizan las frondas esto mediante un tratamiento especial y posterior empaque.
Precios del producto: El precio del producto, dependerá además de la disponibilidad estacional, de la aplicación a la que se destina; si la aplicación es para consumo directo en granjas de cultivo, no implica el secado, su precio estará entre $3 a $5 pesos por kilogramo fresco; algo similar es si se destina a fertilizantes líquidos; para la elaboración de forrajes, se requiere colecta, secado y empaque, por lo que el precio se eleva de $10,000 a $12,000 MXN por tonelada seca; para alimento humano el precio puede elevarse a más de $20,000 MXN por tonelada seca.
Mercado del producto: Debido a que los recursos algales a nivel mundial están disminuyendo su biomasa y es cada vez mayor su demanda debido al éxito de nuevas aplicaciones, que ha aumentado el mercado nacional e internacional de las algas marinas.
XI. INFORMACIÓN Y TRÁMITES
I. CONAPESCA: www.gob.mx/conapesca
II. SENASICA: www.gob.mx/senasica
III. SEMARNAT: www.gob.mx/semarnat
IV. CONAGUA: www.gob.mx/conagua
V. SEMAR: https://www.gob.mx/semar
XII. NORMATIVIDAD
Para esta especie no se cuenta con ninguna normatividad específica, para normatividad general consultar anexo.
XIII. MANEJO ECOSISTÉMICO
I. Mantener las praderas silvestres en buen estado con colectas en las épocas de mayor crecimiento para evitar desprendimientos y arribazones excesivas.
II. La creación de cultivos en diferentes zonas promoverá la formación de hábitat nuevo favoreciendo el desarrollo de comunidades marinas.
III. Promover la recuperación de poblaciones naturales mediante un programa de repoblamiento.
IV. En diferentes localidades costeras, promover cultivos multitróficos integrados con especies de alto valor comercial siendo con ello fuentes de nuevos empleos.
V. Implementar programas de diversificación de aplicaciones de las materias cosechadas en busca de valor agregado.
VI. Para un mayor beneficio ambiental y económico, implementar cosecha que permita regeneración de las plantas.
VII. Mejorar el nivel socioeconómico de los actores.
VIII. Desarrollar un plan de manejo acuícola para esta especie.
IX. Se requiere tomar acciones transversales para la pesca y acuacultura para el fortalecimiento de los bancos pesqueros e impulso de la competitividad.
XIV. INVESTIGACIÓN Y BIOTECNOLOGÍA
Desarrollo tecnológico: El maricultivo de macroalgas ha remplazado en algunos países las cosechas de mantos naturales, con ello se evitan disturbios en las praderas silvestres.
Control total de los ciclos reproductivos generando en laboratorio las esporas e inoculando en materiales que posteriormente se plantan en la zona seleccionada.
Implementar programas de mejoramiento genético seleccionando organismos con mayor tolerancia a los cambios ambientales, mejores tasas de crecimiento y mejor contenido nutrimental.
Fomentar cultivos multitróficos que incluyan algas marinas a gran escala y organismos que las utilicen como alimento y que a su vez las algas marinas aprovechen las excretas generadas, evitando con ello la eutroficación de las aguas.
Sanidad: Identificar zonas costeras libres de descargas antropogénicas, que pudieran provocar una carga
bacteriana excesiva o la presencia de metales pesados. Evitar proliferación de especies indeseables.
Comercialización: Desde 1959 que inició el aprovechamiento de los bancos silvestres de Baja California, se comercializó en fresco para la obtención de alginatos en San Diego California, Estados Unidos de América; esta actividad cesó en el año 2004. A partir de entonces se comercializa para la obtención de fertilizantes líquidos y como alimento para abulón en cultivo, obteniendo un mayor beneficio económico por tonelada de alga fresca.
Buscar mercados alternos a mediano plazo, incorporarlo como alimento en los cultivos comerciales de abulón y otros organismos marinos en cultivo; de igual manera buscar mercado como complemento en forrajes para uso animal; desarrollar nuevas aplicaciones acordes a nuestros usos y costumbres. Explorar el mercado asiático.
Tecnología de alimentos: Desarrollar o adaptar aplicaciones del alga Eisenia arborea en alimento humano, y como alimento funcional.
Obtener compuestos bioactivos tales como fucoidán y antioxidantes.
XV. EFECTOS AMBIENTALES Y CAMBIO CLIMÁTICO
Como consecuencia de los efectos del cambio climático, seleccionar áreas que mantengan condiciones de cultivo estable.
Consideraciones: Los cambios en la distribución, en la composición de las especies y en los hábitats, harán que se hagan modificaciones en las prácticas acuícolas, en donde se tendrá que modificar la ubicación de las instalaciones.
Mejorar la selección de cepas para conseguir mayor tolerancia a temperaturas más altas y mejor crecimiento y contenido nutricional.
Mejorar la planificación y el emplazamiento de las instalaciones, ajuste al cambio climático, regulación del seguimiento.
XVI. ESTADÍSTICAS DE PRODUCCIÓN
No hay registros de producción.
3.6 Robalo blanco
I. GENERALIDADES
Nombre común: Robalo blanco, robalo común.
Nombre científico: Centropomus undecimalis (Bloch, 1792).
Nivel de dominio de la biotecnología: Parcial (avances en la reproducción y cultivo).
Origen: Costa del Atlántico, desde Florida, Estados Unidos de América, hasta Brasil, incluyendo el Golfo de México y el Mar Caribe.
Estatus del cultivo: En etapa experimental.
Mercado: Local, regional y nacional.
Limitantes técnico-biológicas de la actividad: Biotecnología para la producción de crías, engorda y nutrición. Se requiere de una producción segura de juveniles que soporte la actividad. Así como la falta de oferta de alimentos balanceados para la especie.
II. ENTIDADES DE CULTIVO
De acuerdo a la distribución geográfica de la especie su cultivo podría darse en Tamaulipas, Veracruz, Tabasco, Campeche, Yucatán y Quintana Roo.
III. ANTECEDENTES DE LA ACTIVIDAD
En 1994, la entonces Secretaría de Pesca (SEPESCA) y el CIBNOR realizaron un estudio para conocer el estatus del cultivo de Robalo en México, concluyendo que no se contaba con una tecnología de cultivo de las especies nacionales de Centropómidos; asimismo, dan los primeros lineamientos y recomendaciones para su cultivo. A finales de los 90´s, y el año 2002, la Facultad de Ciencias de la Universidad Nacional Autónoma de México (UNAM) Campus Sisal, a través del Laboratorio de Ecología y Biología Marina Experimental, lograron que ejemplares cultivados desde juveniles inmaduros, iniciaran la vitelogénesis, con la posterior inducción a la maduración final y desove; de los resultados más sobresalientes y en colaboración con el CIAD Unidad Mazatlán, en el año 2010 obtuvieron 70,000 juveniles completamente destetados a los 45 días de cultivo, de un lote de reproductores en cautiverio. En la Universidad Juárez Autónoma de Tabasco se han logrado avances importantes en el desarrollo gonádico y la reproducción del Robalo. Asimismo, se han desarrollado cultivos en estanques de manto freático de agua salobre y dulce, así como en Sistemas de Recirculación, con resultados promisorios. Actualmente el INAPESCA se encuentra realizando estudios para completar el ciclo del cultivo.
IV. INFORMACIÓN BIOLÓGICA
Distribución geográfica: Costa del Atlántico, desde Florida, Estados Unidos, hasta Brasil. En el Golfo de México se le encuentra desde Tamaulipas hasta la Laguna de Términos, Campeche, y el Caribe, siendo particularmente más abundante en Veracruz y Tabasco.
Morfología: Cuerpo robusto, plateado brillante con tonos azul grisáceo en el dorso y costados oscurecidos por pequeños puntos negros. Presenta frente inclinada, mandíbula inferior sobresaliente, línea lateral prominentes y forma alargada del cuerpo. Línea lateral negra y recta. La segunda espina anal no alcanza la vertical de la base caudal; tampoco las aletas pectorales alcanzan la vertical de la punta de las aletas pélvicas. El maxilar alcanza o sobrepasa la vertical medida desde el centro del ojo.
Ciclo de vida: Organismos catádromos. Los adultos maduros se encuentran en las desembocaduras de los ríos y lagunas costeras, en los meses cálidos y con mayor escorrentía, a salinidades de 30 a 35 g/L, 10 a 15 m de profundidad y 24 a 29 ºC de temperatura, donde se realiza el desove. Los juveniles se trasladan del agua salobre hacia el interior de los ríos para continuar su ciclo de maduración. Normalmente una a dos hembras son inducidas a desove por tres a seis machos, sin embargo, las relaciones de sexo pueden variar debido a que presentan hermafroditismo protándrico. Una hembra de 750 mm de longitud puede desovar 1.25 millones de huevos por postura y una de 1200 mm puede desovar hasta 4 millones de huevos. Los machos alcanzan su madurez sexual entre 52 y 79 cm y 81.6 cm para hembras.
Hábitat: Especie demersal estuarina. En la etapa juvenil, habita en afluentes de agua dulce, marismas y lagunas costeras, en fondo blando, arenoso y fangoso de aguas no muy profundas; posteriormente se trasladan del agua salobre hacia el interior de los ríos para continuar su etapa de crecimiento, en busca de zonas de protección y alimentación. Poseen amplio intervalo de tolerancia a la salinidad y temperatura, razón por la cual alternan su etapa de crecimiento en aguas someras y con fluctuaciones en la concentración de sales.
Alimentación en medio natural: Son carnívoros oportunistas. Se alimentan principalmente de otros peces pelágicos de menor tamaño, como anchoveta, mojarra, ronco, sardina, y peces de agua dulce como cíclidos y "topen" o "naca" Dormitator maculatus, así como camarones peneidos y palemónidos. En la etapa de cría y juvenil se alimenta de zooplancton y microcrustáceos.
V. CULTIVO - ENGORDA
Biotecnología: Parcial (avances en la producción de crías y en el cultivo).
Sistema de cultivo: Superintensiva (sistemas de recirculación), intensiva (jaulas flotantes), semintensiva (estanques y tanques) y extensiva (corrales y encierros). También se cultiva en estanques rústicos de agua dulce o salobre con otras especies como chucumite, tilapia o lisa.
Características de la zona de cultivo: Sitios protegidos contra vientos, mareas y oleaje, como estuarios y lagunas costeras de baja corriente. Los Robalos pueden cultivarse en agua salobre, salada o incluso dulce.
Artes de cultivo: Jaulas flotantes, estanques rústicos, tanques recubiertos con "Liners", corrales y encierros.
Promedio de flujo de agua para cultivo: En Sistemas de Recirculación para Acuacultura (SRA), recambios diarios inicial primer mes de cultivo del 80 - 100%, prengorda de 150 - 200% y engorda de 200-350% del total de agua del Sistema. En el medio natural, aproximadamente 10 cm/s.
Densidad de siembra: 2 a 5 org/m3 para estanques, de 5 a 10 org/m3 para jaulas y 10 a 15 org/m3 para SRA, dependiendo de la talla de cosecha.
Tamaño del organismo para siembra: de 1 a 10 gramos, crías de 30 a 45 días aproximadamente.
Porcentaje de sobrevivencia: más del 80% en etapa de engorda.
Talla promedio de cosecha: hasta 0.8 a 1.0 kg en un año, o hasta 3 a 5 kg en 18-20 meses de cultivo.
VI. PIE DE CRÍA
Origen: Silvestre y de laboratorio (en fase experimental).
Procedencia: juveniles y adultos colectados del medio silvestre principalmente de Tamaulipas, Veracruz, Tabasco y Campeche.
VII. ALIMENTO
Tipo de alimento: Alimento fresco congelado, entero o en trozos, como sardina, lebrancha, gurrubata, entre otros, así como camarones peneidos. Alimento inerte en etapa experimental.
VIII. PARÁMETROS FÍSICO-QUÍMICOS
| VARIABLE DE CALIDAD
| ÓPTIMO
| |
| Temperatura ºC
| 28
| 10 - 35
|
| Oxígeno disuelto (mg/L)
| 4
| 2 - saturación
|
| pH
| 7.5
| 6.5 - 8.5
|
| Salinidad (g/L)
| 20 - 30
| 0 - 40
|
| Amonio (mg/L)
| < 0.1
| < 0.1 - 1
|
MIN - MAX
IX. SANIDAD Y MANEJO
Importancia de la Sanidad Acuícola: En la Ley General de Pesca y Acuacultura Sustentables (LGPAS), a partir del 22 de octubre de 2007, se establecen los lineamientos en materia sanitaria para la pesca y acuacultura en México. Dado el rápido crecimiento de la acuacultura en el país, es importante establecer y adoptar medidas sanitarias para la prevención, diagnóstico, detección, control y erradicación de enfermedades.
Enfermedades reportadas: Bacterias del género pseudomonas, síntomas: nado errático, enrojecimiento de la base de las aletas y el hocico, pérdida de apetito; si no es atendida, causa la muerte de los ejemplares. Posibles bacterias del género Vibrio, como V. harveyi; se ha reportado causar opacidad en córnea y hasta ceguera en peces marinos. Parásitos monogéneos como Rhabdosynochus spp, que infecta los filamentos branquiales, lo que provoca hiperplasia epitelial, elevada producción de mucus e infestación en el cultivo. Estos parásitos no provocan zoonosis por lo tanto no son transmisibles al ser humano.
Buenas prácticas de producción acuícola: Además de los procedimientos de operación internos de una UPA, se requiere de lineamientos estandarizados que permitan una producción acuícola sustentable, de alta calidad e inocuidad.
Buenas prácticas de higiene: Reglamento de higiene y seguridad en la acuacultura, que toma en cuenta los programas de mantenimiento preventivo, limpieza y desinfección, de control de plagas, de control de aguas, de proveedores, de trazabilidad, así como la salud e higiene del personal, que puedan ofrecer a los consumidores un producto de calidad certificable. El cumplimiento de los estándares de calidad e higiene mediante el Análisis de Peligros y Puntos de Control Críticos (APPCC) en la acuacultura, permite además de garantizar la inocuidad del producto, la posibilidad de introducir el producto en mercados internacionales.
X. MERCADO
Presentación del producto: Fresco entero, eviscerado, enhielado, congelado, en rodajas o "postas" y en filete (rendimiento del 40-60%).
Precios del producto: De $145 a $200 MXN dependiendo del tamaño y el lugar.
Más información en: http://www.economia-sniim.gob.mx/SNIIM-pesca/estadisticas/e_pez.asp
Talla promedio de presentación: Entero de 30 y 40 cm. Los de mayor tamaño regularmente se adquieren por restaurantes, o se venden al público en postas o filete.
Mercado del producto: Nacional.
Puntos de venta: Actualmente en los Centros de acopio de las cooperativas y pescaderías.
XI. INFORMACIÓN Y TRÁMITES
I. SEMARNAT: www.gob.mx/semarnat
II. CONAPESCA: www.gob.mx/conapesca
III. SENASICA: www.gob.mx/senasica
IV. CONAGUA: www.gob.mx/conagua
XII. NORMATIVIDAD
Para esta especie no se cuenta con ninguna normatividad específica, para normatividad general consultar anexo.
XIII. MANEJO ECOSISTÉMICO
I. Impulsar el desarrollo de dietas específicas, las cuales permitan obtener resultados satisfactorios en la engorda de la especie, considerando las principales características del producto final en el mercado (color, forma y textura de la carne) además de garantizar la sostenibilidad de la actividad contribuyendo a mejorar la tasa de conversión de la especie y los costos de producción.
II. El SENASICA actualmente construye los procesos con información técnica sanitaria, para implantar
las verificaciones que sustenten la emisión del certificado sanitario tanto para laboratorios de producción de organismos acuáticos, como para las instalaciones en que se desarrollan las engordas.
III. Promover la formación de plantas piloto para la producción de juveniles, tanto con fines de investigación como de escalamiento a nivel comercial, esto ofertaría cría para la actividad acuícola y reducirá la presión que existe en las poblaciones silvestres.
IV. Tecnificación de la maricultura.
V. Establecimiento de un Programa Nacional de Bioseguridad, para la certificación sanitaria continua de las líneas de reproductores y crías-juveniles.
VI. Constituir políticas que promuevan sociedades o unidades de productores a diferentes escalas.
VII. Establecer los requerimientos y medidas para prevenir y controlar la introducción y dispersión de enfermedades de alto riesgo en el cultivo.
XIV. INVESTIGACIÓN Y BIOTECNOLOGÍA
Genética: Desarrollo de un banco de reproductores, mediante un programa de mejoramiento genético, con el fin de producir crías de Robalo, de manera segura, continua y masiva.
Nutrición: Estudios sobre aspectos nutrimentales, para las diferentes etapas de vida de los especímenes, que satisfaga los requerimientos dietéticos de los organismos, y que permita mayor ganancia en peso y talla, así como reducción en los tiempos de producción y cosecha.
Sanidad: Estudios sobre aspectos sanitarios y patológicos, para llevar un registro y control del estado de salud de los especímenes, que permitan tomar acciones correctivas y preventivas ante cualquier cuadro clínico que se presente durante la producción crías o cultivo.
Comercialización: Estudios concernientes a dar valor agregado al producto mediante nuevas presentaciones en el mercado, de mejor calidad y tiempo de vida en anaquel.
Manejo: Dado al alto precio en el mercado, sólo se acepta el producto de buena calidad. De ahí la importancia de un manejo adecuado, evitando al máximo maltratarlo o deteriorarlo. Desarrollar estudios encaminados al manejo o manipulación durante el cultivo y postcosecha, para mantener la calidad del producto.
Tecnología de cultivo: Desarrollar sistemas de cultivo eficientes para la producción de peces marinos, mediante el diseño e innovación de técnicas de Recirculación para Acuacultura. Asimismo, diseñar artes de cultivo eficientes para la engorda, de menor costo y mayor calidad, que redunde en mejores resultados finales.
Ecología: Realizar estudios sobre aptitud de cuerpos de agua como lagunas costeras, estuarios o ríos, con el fin de ubicar sitios para el cultivo de Robalo, que permitir su buen desarrollo, y se reduzca el impacto tanto al cultivo como al ambiente. Generar investigación en torno a los estudios de prospección para identificar zonas con vocación acuícola para el cultivo de la especie de forma sustentable.
Instituciones de investigación: Actualmente se encuentran trabajando en diferentes procesos para el cultivo de robalo como: UNAM campus Sisal, CRIP-INAPESCA Tampico, Instituto Tecnológico de Boca del Río, UJAT, entre otras.
XV. EFECTOS AMBIENTALES Y CAMBIO CLIMÁTICO
Los cambios en la distribución en la composición de las especies y en los hábitats, fomentarán que se realicen modificaciones en las prácticas acuícolas, como serían la ubicación de las instalaciones o el optimizar las prácticas alimenticias.
Como medidas de adaptación, se recomienda lo siguiente:
I. Mejorar la selección de crías para conseguir la tolerancia a temperaturas más altas.
II. Mejorar la planificación y el emplazamiento de las instalaciones, ajuste al cambio climático, regulación del seguimiento.
III. Prevención y seguir las normas sanitarias para prevenir riesgos sanitarios.
XVI. ESTADÍSTICAS DE PRODUCCIÓN
No se disponen cifras oficiales para el cultivo de esta especie.
3.7 Sargazo gigante
I. GENERALIDADES
Nombre común: Sargazo gigante.
Nombre científico: Macrocystis pyrifera (L.) C. Agardh.
Nivel de dominio de la biotecnología: Completo.
Origen: Macrocystis es el género de algas pardas más ampliamente distribuido en el mundo; forma densos bosques en las regiones templadas y frías de ambos hemisferios.
Estatus del cultivo: Experimental.
Mercado: Consumo nacional y exportación.
Limitantes técnico-biológicas de la actividad: El organismo seleccionado para cultivo, deberá ser sano, tener una tasa de crecimiento alta, permanencia en el medio durante todo el año (o la mayor parte de éste), poseer características reproductivas que permitan garantizar cepas en cualquier momento, poder obtener esporas en laboratorio.
II. ENTIDADES DE CULTIVO
Baja California y Baja California Sur.
III. ANTECEDENTES DE LA ACTIVIDAD
M. pyrifera o "sargazo Gigante", es una especie de alga parda que forma extensos bosques submareales en las aguas templadas de la costa del Pacífico en Baja California; generalmente se le asocia positivamente a pesquerías importantes en la región, como la del abulón, erizo de mar y langosta, entre otros que utilizan los bosques de macroalgas como alimentación y o refugio en diferentes etapas de su vida. Su distribución y abundancia en nuestras costas ha ido cambiando en el tiempo, generalmente con una tendencia a la disminución, probablemente debido a los cambios ambientales. Tiene un historial de aprovechamiento que data de 1959, desde sus inicios se empleó como materia prima para la industria de alginatos en E.U.A.; sin embargo, en el 2004 esa actividad cesó y en su lugar se emplea directamente como alimento en las granjas de cultivo de abulón y fertilizantes líquidos. Investigadores del Instituto de Investigaciones Oceanológicas (IIO-UABC), cuentan con biotecnia de cultivo de ésta y otras especies de macroalgas.
IV. INFORMACIÓN BIOLÓGICA
Distribución geográfica: En México se distribuye en la región templada del Pacífico de la península de Baja California, desde la frontera con Estados Unidos hasta Bahía Tortugas en BCS.
Morfología: Es una planta que se desarrolla en fondos rocosos donde se fija con una fuerte estructura densamente ramificada o rizoide, de éste se desprenden varios talos o estipes (que pueden ser hasta 30 por órgano de fijación), éstos crecen hacia la superficie; lateralmente de los talos se desprenden unas láminas de forma lanceolada corrugada, con márgenes dentados y en la base de cada lámina en unión al estipe posee unas vesículas de aire (pneumatocistos) de forma periforme que le sirven para mantener erecta la planta en la columna de agua; al final de cada estipe se encuentra la zona apical que se distingue por ser una especie de abanico en cuya base se observa la incipiente formación de láminas. De igual manera en la base de la planta se encuentran unas láminas más delgadas que las propias de la planta que son los esporofilos, láminas especializadas que contienen a los soros (agrupación de esporas) que posteriormente liberarán las esporas.
Ciclo de vida: El orden laminariales al que pertenece M. pyrifera posee un ciclo de vida donde hay alternancia de generaciones esporofito-gametofito (Brandt, 1923; Delf y Levyn,1926); es un ciclo de vida heteromorfo, donde las plantas gametofitas son microscópicas, mientras que las plantas esporofitas son macroscópicas. Los esporofitos (planta macroscópica) posee estructuras reproductivas (zoosporangios) en láminas especializadas que se encuentran en la base de la planta, estas estructuras, eventualmente liberan las zoosporas (n) dando lugar a las plantas gametofitas (n) hembra o macho (microscópicas), las cuales participan en la fecundación (cigoto 2n) que da lugar a la planta esporofita macroscópica esporofito (2n).
Este género se compone de organismos dioicos, con ciclo de vida alternante esporofito-gametofito (diploide-haploide), poseen una fase macroscópica dominante que es el esporofito diploide. Cuando los organismos son fértiles, la porción distal media de las hojas desarrollan numerosos "soros" que son agregaciones de esporangios. Se liberan zoosporas biflageladas que se asientan y germinan para formar los gametofitos haploides microscópicos. Los gametofitos a su vez liberan gametos biflagelados que se fusionan para formar los cigotos que, al germinar, forman la generación esporofita completando el ciclo de vida.
Hábitat: Crecen en los márgenes de los océanos, principalmente en costas rocosas de zonas frías y templadas. Verticalmente se distribuye de los 3 a los 25 m de profundidad (North, 1969), predominando en la isobata de los 18 m (Molina-Martínez, 1986).
Alimentación en medio natural (requerimientos de nutrientes): Estos organismos pertenecen al reino vegetal, aprovechan la luz solar para realización de la fotosíntesis, que es la base para la formación de materia orgánica y los nutrimentos tales como nitrógeno, fósforo, carbono entre otros, los toman como compuestos inorgánicos directamente de las aguas en que se desarrollan.
V. CULTIVO - ENGORDA
Biotecnología: Se cuenta con la biotecnología completa para el cultivo de esta especie. El material reproductivo (esporofilos), se recolectan directamente de plantas que crecen en el medio natural, se transportan en hieleras (sin agua) al laboratorio donde son lavadas y cepilladas con agua dulce y después con agua de mar; posteriormente se colocan trozos de esporofilos con soros en cámaras de inoculación con agua de mar filtrada y esterilizada con UV donde se encuentra una cuerda de nylon de aprox. 2 mm de diámetro sobre un tubo de PVC. Después de inoculadas las cuerdas, se dejan reposar de 24 a 48 horas en oscuridad total a temperaturas entre 10 y 12 °C. Posteriormente los tubos con la cuerda se colocan en tanques de cultivo iluminados y aireados; se monitorea al microscopio el desarrollo de los gametofitos. Después de tres a cuatro semanas se comenzará a observar el crecimiento de los esporofitos juveniles los cuales pueden tener un periodo de aclimatación-crecimiento en tanques exteriores con suministro de aire, agua de mar circulante y suministro de nutrientes. Una vez que alcancen tallas entre 1 a 2 mm podrán trasladarse al mar.
Sistemas de cultivo: piloto y experimental.
Características de la zona de cultivo: Deben ser zonas con fondos rocosos, con corrientes moderadas, en aguas limpias y transparentes libres de descargas antropogénicas.
Artes de cultivo:
Va de acuerdo a las diferentes etapas de cultivo, la etapa de inoculación se hace en cámaras en el laboratorio; luego se usan tanques o piletas con agua corriente y burbujeo y finalmente se trasladan a la zona marina seleccionada, las cuerdas con los organismos esporofitos, donde se adhieren a las rocas con el órgano de fijación.
Para el traslado de las frondas al Sistema Suspendido, se retiran cuidadosamente los ejemplares del bastidor y por medio de un encordado, la cuerda con los esporofitos se enrolla cuidadosamente a lo largo de la cuerda de nylon de 1.8 cm de diámetro (Celis y Alveal 2003, Buchsman et al., 2006). Las cuerdas se atan en sus extremos a peso muerto y para mantener la línea a profundidad constante se usan boyas distribuidas a lo largo de la cuerda.
Promedio de flujo de agua para el cultivo: Los cultivos de sargazo gigante, tanto en mar como en tierra, deben contar con flujos de agua continuos que permitan el abastecimiento de los nutrimentos. La cuantía del flujo dependerá de la cantidad de nutrimentos que contenga el agua de abastecimiento, así como la densidad de los cultivos. Cuando los flujos sean bajos, se podrá considerar la adición de fertilizantes.
Densidad de siembra: En la fase inicial del desarrollo de los esporofitos (1 a 2 mm), se puede colocar una alta densidad de plantas (100 por m lineal), sin embargo, a medida que crecen se hace una selección eliminando a los juveniles más pequeños.
Tamaño del organismo para siembra: Entre 15 a 25 cm.
Porcentaje de sobrevivencia: 100%.
Tiempo de cultivo: 4 a 6 meses.
Tamaño promedio de cosecha: variable.
VI. PIE DE CRÍA
Origen: La península de Baja California.
Procedencia: Praderas naturales de macroalgas.
VII. ALIMENTO
En laboratorio y estanques el aporte de nutrientes se realiza mediante la adición de fertilizantes agrícolas.
VIII. PARÁMETROS FÍSICO-QUÍMICOS
En las etapas de laboratorio y estanques, se recomienda el pH entre 8.0 y 8.2; la densidad de flujo fotónico en valores de 35 a 50 mol-fotón/m2 S-1. La salinidad sugerida es de 28 a 33 partes por mil y la temperatura de 11 a 13 º C. El aporte de burbujeo se realiza mediante un soplador. Los recambios de agua se harán en forma semanal (Celis y Alveal, 2003).
| PARÁMETRO | MÍN
| MÁX
|
| Temperatura (°C) | 10
| 12
|
| Salinidad (ups) | 30
| 34
|
| Oxígeno (mg/l) | > 7
|
| Ph | 8.0
| 8.5
|
| Transparencia (m) | 2-10
|
IX. SANIDAD Y MANEJO
Importancia de la sanidad acuícola: Un manejo sanitario estricto de las instalaciones de cultivo, tomas y tratamiento de agua de alimentación, así como limpieza de las instalaciones de laboratorio en todos los procesos implicados, evitará la aparición de enfermedades en las cepas destinadas al cultivo, así como la proliferación de fauna nociva.
Enfermedades reportadas: No se han reportado enfermedades en este recurso, sin embargo, si hay riesgo de acumulación excesiva de biomasa algal, que, de no manejarse apropiadamente, puede originar arribazones masivos en la costa o crear condiciones anóxicas en cuerpos de agua con poca circulación y afectar a la fauna circundante.
Buenas prácticas de producción acuícola: Establecer instalaciones para el filtrado y tratamiento de las aguas de alimentación con luz ultravioleta, de igual manera tratar las aguas de descarte para evitar florecimientos algales sin control; además establecer unidades de cuarentena para los organismos a cultivar, evitando con ello la proliferación de fauna nociva.
X. MERCADO
Presentación del producto: Cuando el propósito es el consumo como alimento o su uso como fertilizantes líquidos, la cosecha, se traslada en fresco directamente a los centros de consumo; por otra parte, si se van a aprovechar como materias primas para procesos como alimentos balanceados, o complementos alimenticios y si los centros de aprovechamiento se encuentran lejos de la zona de producción, se requiere entonces un tratamiento para su conservación y transporte, en este caso la deshidratación al sol y embalado en pacas de 80 a 100 Kg es la mejor opción.
Precios del producto: El precio del producto, dependerá además de la disponibilidad estacional, de la aplicación a la que se destina; si la aplicación es para consumo directo en granjas de cultivo, no implica el secado, su precio estará entre $1 a $3 MXN por kilo fresco; algo similar sucede si se destina a fertilizantes líquidos; para la elaboración de forrajes, se requiere colecta, secado y empaque, por lo que el precio se eleva de $10,000 a $12,000 MXN por tonelada seca.
Mercado del producto: Debido a que los recursos algales a nivel mundial están disminuyendo su biomasa y es cada vez mayor su demanda debido al éxito de nuevas aplicaciones, que ha aumentado el mercado nacional e internacional de las algas marinas.
XI. INFORMACIÓN Y TRÁMITES
I. CONAPESCA: www.gob.mx/conapesca
II. SENASICA: www.gob.mx/senasica
III. SEMARNAT: www.gob.mx/semarnat
IV. CONAGUA: www.gob.mx/conagua
V. SEMAR: https://www.gob.mx/semar
XII. NORMATIVIDAD
Para esta especie no se cuenta con ninguna normatividad específica, para normatividad general consultar anexo.
XIII. MANEJO ECOSISTÉMICO
I. Mantener las praderas silvestres en buen estado con colectas en las épocas de mayor crecimiento para evitar desprendimientos y arribazones excesivas.
II. La creación de cultivos en diferentes zonas promoverá la formación de hábitat nuevo favoreciendo el desarrollo de comunidades marinas.
III. Promover la recuperación de poblaciones naturales mediante un programa de repoblamiento.
IV. En diferentes localidades costeras, promover cultivos multitróficos integrados con especies de alto valor comercial siendo con ello fuentes de nuevos empleos.
V. Implementar programas de diversificación de aplicaciones de las materias cosechadas en busca de valor agregado.
VI. Mejorar el nivel socioeconómico de los actores.
VII. Desarrollar un plan de manejo acuícola para esta especie.
VIII. Se requiere tomar acciones transversales para la pesca y acuacultura para el fortalecimiento de los bancos pesqueros e impulso de la competitividad.
XIV. INVESTIGACIÓN Y BIOTECNOLOGÍA
Desarrollo tecnológico: El maricultivo de macroalgas ha remplazado en algunos países las cosechas de mantos naturales, con ello se evitan disturbios en las praderas silvestres.
Control total de los ciclos reproductivos generando en laboratorio las esporas e inoculando en materiales que posteriormente se plantan en la zona seleccionada.
Implementar programas de mejoramiento genético seleccionando organismos con mayor tolerancia a los cambios ambientales, mejores tasas de crecimiento y mejor contenido nutrimental.
Fomentar cultivos multitróficos que incluyan algas marinas a gran escala y organismos que las utilicen como alimento y que a su vez las algas marinas aprovechen las excretas generadas, evitando con ello la eutroficación de las aguas.
Sanidad: Identificar zonas costeras libres de descargas antropogénicas, que pudieran provocar una carga bacteriana excesiva o la presencia de metales pesados. Evitar proliferación de especies indeseables.
Comercialización: Desde 1959 que inició el aprovechamiento de los bancos silvestres de Baja California, se comercializó en fresco para la obtención de alginatos en San Diego California, Estados Unidos de América; esta actividad cesó en el año 2004. A partir de entonces se comercializa para la obtención de fertilizantes líquidos y como alimento para abulón en cultivo, obteniendo un mayor beneficio económico por tonelada de alga fresca.
Buscar mercados alternos a mediano plazo, incorporarlo como alimento en los cultivos comerciales de abulón y otros organismos marinos en cultivo; de igual manera buscar mercado como complemento en forrajes para uso animal; desarrollar nuevas aplicaciones acordes a nuestros usos y costumbres. Explorar el mercado asiático.
Tecnología de alimentos: Desarrollar o adaptar aplicaciones del alga Macrocystis pyrifera en alimento humano, y uso de los alginatos en productos como geles, carne reconstituida entre otros.
Obtener compuestos bioactivos tales como fucoidán y antioxidantes.
XV. EFECTOS AMBIENTALES Y CAMBIO CLIMÁTICO
Como consecuencia de los efectos del cambio climático, seleccionar áreas que mantengan condiciones de cultivo estable.
Consideraciones:
Los cambios en la distribución, en la composición de las especies y en los hábitats, harán que se hagan modificaciones en las prácticas acuícolas, en donde se tendrá que modificar la ubicación de las instalaciones.
Mejorar la selección de cepas para conseguir mayor tolerancia a temperaturas más altas y mejor crecimiento y contenido nutricional.
Mejorar la planificación y el emplazamiento de las instalaciones, ajuste al cambio climático, regulación del seguimiento.
XVI. ESTADÍSTICAS DE PRODUCCIÓN
Aún no se desarrolla comercialmente.
3.8 Ulva
I. GENERALIDADES
Nombre común: Alga verde "Aonori".
Nombre científico: Ulva clathrata (Roth) C. Agardh 1811.
Nivel de dominio de biotecnología: Completo.
Origen: Cepa seleccionada con características específicas a partir de alga endémica de la zona del litoral de la Península de Baja California.
Mercado: Exportación y nacional.
Limitantes técnico-biológicas de la actividad: Mantener una temperatura óptima de cultivo (entre 20 a 25°C).
II. ENTIDADES DE CULTIVO
Sinaloa, Baja California y Baja California Sur.
III. ANTECEDENTES DE LA ACTIVIDAD
La distribución cosmopolita del género Ulva, lo hace adecuado para cultivarse en variados ambientes (Ben-ari et al., 2014). Además las especies de Ulva, poseen varias características favorables para su aprovechamiento comercial, tales como, altas tasas de crecimiento, alta concentración de nitrógeno en el tejido, ser resistentes a epífitas y organismos causantes de enfermedades, resistentes a altas concentraciones de nutrientes y eficientes para remover nutrientes inorgánicos; además tienen un papel importante en la captación de carbono por lo que hacen que sean candidatas ideales para la biorremediación de aguas contaminadas o eutroficadas (Neori et al., 2004; Matos et al., 2006; Lawton et al., 2013; Pereira and Correia, 2015; Grote, 2016).
En 1990, el Dr. Benjamin Moll y la Dra. Jill Deikman de la Universidad de Pensilvania, determinaron que el cultivo de Ulva clathrata tenía un gran potencial como cultivo de alto rendimiento en estanques con poca profundidad y bajo recambio de agua. Entre los años 2005 y 2009, se realizaron cultivos pilotos en granjas de camarón durante la época invernal en el estado de Sinaloa. Sin embargo, debido a las temperaturas altas durante el verano que imposibilitan el cultivo del alga, se optó en 2011 por iniciar el cultivo en la costa occidental de Baja California, donde las temperaturas oceánicas son más bajas e ideales para el cultivo del alga durante gran parte del año.
Desde hace unos años (2005), investigadores del Instituto de Investigaciones Oceanológicas de la Universidad Autónoma de Baja California (IIO-UABC), desarrollan cepas resistentes a las altas temperaturas en cultivo controlados y biomasa en cultivos en estanques exteriores de Ulva clathrata y desde el 2015 desarrolla cultivo semicomercial con especies de Ulva de talo laminar.
IV. INFORMACIÓN BIOLÓGICA
Distribución Geográfica: Se distribuye en todo el mundo (cosmopolita).
Morfología: Macroalga verde claro brillante, de 20 - 80 mm de largo, muy ramificada irregularmente desde la base, de filamentos finos de 1 - 3 mm de ancho, cilíndrica o ligeramente plana.
Ciclo de vida: Haplóntico, diplóntico, haplodiplóntico, isomórfico y heteromórfico.
Hábitat: Aguas intermareales, someras que pueden o no tener aportes de agua dulce.
Alimentación en medio natural: Nutrientes elementales presentes en el agua marina.
V. CULTIVO - ENGORDA
Biotecnología: Completa y estandarizada.
Sistemas de cultivo: Intensivo en estanques de tierra y/o recubiertos con geomembrana de HDPE. El alga se multiplica vegetativamente por fragmentación.
Características de la zona de cultivo: Tierras costeras áridas con aguas frías de la Costa Occidental de Baja California.
Promedio de flujo de agua para el cultivo: En promedio de 5 a 10% de recambio de agua semanalmente en los estanques.
Densidad de siembra: 300 a 400 kg por hectárea.
Tamaño del organismo para siembra: Manojos de aproximadamente 50 g de material fresco.
Porcentaje de sobrevivencia: N/A.
Tiempo de cultivo: 4-6 semanas.
Tamaño promedio de cosecha: 23 t húmedas por hectárea. En etapa inicial del cultivo se puede cosechar de 50 a 75 Kg/hectárea/día, en etapa de madurez hasta 150 Kg/hectárea/día (5 t húmedas por hectárea por mes).
VI. PIE DE CRÍA
Mantenimiento de cepas en laboratorio en condiciones axénicas para generar esporas y material seleccionado en condiciones de laboratorio que posteriormente se traslada a las pozas de cultivo.
Origen: Nacional.
Procedencia: Laboratorios privados en Baja California y Baja California Sur y de la Universidad Autónoma de Baja California.
VII. ALIMENTO
En cultivo con camarón, su fuente de nutrientes principal es: excretas de camarón, productos de degradación del alimento de camarón y se complementa con una mezcla de fertilizantes agrícolas.
VIII. PARÁMETROS FÍSICO-QUÍMICOS
En las etapas de laboratorio y estanques exteriores.
| PARÁMETRO
| INTERVALO ÓPTIMO DE CULTIVO
|
| Temperatura (°C )
| 20 - 25
|
| Salinidad (ups)
| 30 - 40
|
| Oxígeno (mg/L)
| >7
|
| pH
| 7.5 a 8.5
|
| Transparencia (m)
| 2-10
|
IX. SANIDAD Y MANEJO
Importancia de la sanidad acuícola: Mantener el control de los parámetros fisicoquímicos y concentración de nutrientes en el agua para mantener inocuidad del producto. En la etapa de laboratorio es necesario un manejo sanitario estricto de las instalaciones de cultivo, tomas y tratamiento de agua de alimentación, así como limpieza de las instalaciones en todos los procesos implicados, esto evitará la aparición de enfermedades en las cepas destinadas al cultivo así como la proliferación de fauna nociva.
Durante el cultivo en el campo, es conveniente proteger el perímetro de los estanques con barreras contra el aire para impedir el ingreso de polvo con heces de animales.
Ulva clathrata como un productor primario, puede ser usado en la biorremediación de zonas contaminadas, al controlar algunos parámetros fisicoquímicos y concentración excesivas de nutrientes en los ambientes donde se cultive. Aunque no existen reportes de enfermedades en este recurso, en la etapa de laboratorio es necesario un manejo sanitario adecuado para evitar la aparición de alguna enfermedad o proliferación de fauna nociva en las cepas destinadas al cultivo.
Enfermedades reportadas: ninguna. No existen reportes de enfermedades en este recurso. Sin embargo, el exceso de biomasa algal, de no manejarse apropiadamente, puede originar condiciones anóxicas en cuerpos de agua y afectar a la fauna en cultivo.
Buenas prácticas de producción acuícola: El objetivo es reducir riesgos en las unidades de producción y procesamiento primario de alimentos, tanto para disminuir la incidencia de enfermedades, asegurar la comercialización interna y de exportación. Tratar las aguas de descarte para evitar florecimientos algales sin control; además establecer unidades de cuarentena para los organismos a cultivar, evitando con ello la proliferación de flora y fauna nociva.
Mayor información: Manual de buenas prácticas en la producción acuícola de camarón (https://www.gob.mx/senasica) o con los comités de sanidad acuícola estatales.
X. MERCADO
Presentación del producto: Cuando se van a aprovechar como materias primas para procesos como alimentos balanceados, complementos alimenticios etc., donde los centros de aprovechamiento se encuentran lejos de la zona de producción, se requiere entonces un tratamiento para su conservación y transporte, en este caso es conveniente la deshidratación y molienda y empaque en recipientes herméticos. El material con las mejores características de pureza y apariencia podrá ser destinado a la producción de harinas de Ulva como ingrediente para alimento humano y elaboración de botanas; también podrá ser utilizado como complemento en alimento para ganado y en la elaboración de dietas para organismos en cultivo.
Una opción adicional de uso es en la producción de fertilizantes líquidos.
Precios del producto: El precio del producto, dependerá de la disponibilidad estacional y de la calidad y pureza del producto. De acuerdo a la aplicación a que se destine será el proceso post-cosecha que se aplique, tales como secado, molienda o bien uso fresco directo. Como harina de algas puede tener un costo de $104.00 MXN a $260.00 MXN por kg.
En presentación de extracto líquido puede alcanzar precios de $100 a $150.00 MXN/litro.
Venta: Internacional y nacional. A nivel mundial es cada vez mayor la demanda de las algas marinas y sus productos.
Mercado del producto: Nacional e internacional.
XI. INFORMACIÓN Y TRÁMITES
I. CONAPESCA: www.gob.mx/conapesca
II. SENASICA: www.gob.mx/senasica
III. SEMARNAT: www.gob.mx/semarnat
IV. CONAGUA: www.gob.mx/conagua
V. SEMAR: https://www.gob.mx/semar
XII. NORMATIVIDAD
Para esta especie no se cuenta con ninguna normatividad específica, para normatividad general consultar anexo.
XIII. MANEJO ECOSISTÉMICO
Aprovechamiento de las tierras costeras áridas de la costa Occidental de Baja California y cuya temperatura del agua oceánica es ideal para el cultivo de esta especie de alga.
En diferentes localidades costeras, promover cultivos multitróficos integrados con especies de alto valor comercial donde esta especie además de ser parte de la alimentación de los organismos cultivados (ej. Camarón), contribuye en depuración de las aguas de cultivo ya que actúan como un biofiltro.
I. Certificación de la actividad de producción de algas marinas en estanquería en el país.
a. Certificación del manejo post cosecha para preservar la calidad del producto.
II. Implementar programas de diversificación de aplicaciones de las materias cosechadas en busca de valor agregado.
III. Mejorar el nivel socioeconómico de los actores.
IV. Estimular el comercio para consumo nacional y extranjero.
V. Generar nuevos mercados (productos verdes, entre otros.).
VI. Impulsar la creación de Unidades de Manejo Acuícola para el desarrollo de la actividad en otras regiones del país.
XIV. INVESTIGACIÓN Y BIOTECNOLOGÍA
Genética:
Implementar programas de mejoramiento genético seleccionando organismos con mayor tolerancia a los cambios ambientales, mejores tasas de crecimiento y mejor contenido nutrimental.
Selección y producción de cepas con mejores características de crecimiento y tolerancia a altas temperaturas.
Control total de los ciclos reproductivos, desarrollo de métodos de reproducción vegetativa, así como de la reproducción sexual y asexual (producción de gametos y esporas).
Sanidad: Cuando el alga en cultivo se use como alimenticio (o algún subproducto), se deberá cultivar en zonas costeras libres de descargas antropogénicas, que pudieran provocar una carga bacteriana excesiva o la presencia de metales pesados.
Implementación de sistemas de eliminación de parásitos.
Comercialización: Difusión de los productos de esta actividad para el desarrollo del mercado. Diseño de planes que promuevan el Análisis de Riesgo y Control de Puntos Críticos (HACCP, por sus siglas en inglés) para obtener productos de calidad y competitividad en el mercado tanto nacional como extranjero.
Buscar mercados alternos a mediano plazo, incorporarlo como alimento en los cultivos comerciales de organismos marinos en cultivo; de igual manera buscar mercado como complemento en forrajes para uso animal; desarrollar nuevas aplicaciones acordes a nuestros usos y costumbres.
Explorar el mercado asiático.
Tecnología:
Desarrollo de nuevos productos de alto valor nutricional y sustitutos de ingredientes o alimentos de alto valor calórico y como alimento funcional.
Obtener compuestos bioactivos tales como ulván y antioxidantes.
Elaboración de complementos alimenticios.
Obtención de productos para usos farmacéuticos (ramnosa).
XV. EFECTOS AMBIENTALES Y CAMBIO CLIMÁTICO
Como consecuencia de los efectos del cambio climático, seleccionar áreas que mantengan condiciones de cultivo estable.
Mejorar la selección de cepas para conseguir mayor tolerancia a temperaturas más altas y mejor crecimiento y contenido nutricional.
Mejorar la planificación y el emplazamiento de las instalaciones, ajuste al cambio climático, regulación del seguimiento.
XVI. ESTADÍSTICAS DE PRODUCCIÓN
El desarrollo comercial de esta especie es reciente, inició como parte de la dieta del cultivo de camarón (Cruz-Suárez et al., 2008, 2009, 2010 y Peña-Rodríguez, 2010. Actualmente se producen 16 toneladas secas de harina de Ulva por hectárea por año y parte de la producción se utiliza como fertilizante orgánico en cultivos terrestres.
Por otra parte, los cultivos semicomerciales del IIO-UABC, en 2018 durante 4 meses de operación regular produjeron 6.6 toneladas frescas (1.3 t secas) de Ulva de talo laminar.
4. ESPECIES CON POTENCIAL ACUÍCOLA
4.1 Camarón café
I. GENERALIDADES
Nombre común: Camarón café.
Nombre científico: Farfantepenaeus californiensis (Holmes, 1900).
Nivel de dominio de la biotecnología: Completo.
Origen: Endémico del Pacífico; desde California hasta Perú.
Estatus del cultivo: Comercial.
Mercado: Exportación.
Limitantes técnico-biológicas de la actividad: Abastecimiento de reproductores, los requerimientos nutricionales han sido poco estudiados.
II. ENTIDADES DE CULTIVO
Baja California y Baja California Sur.
III. ANTECEDENTES DE LA ACTIVIDAD
La producción de camarón en México da inicio en el Instituto Tecnológico y de Estudios Superiores de Monterrey Campus Guaymas, al experimentar con el camarón café (Farfantepenaeus californiensis) y con las investigaciones con camarón blanco (L. vannamei), realizadas por la Universidad de Sonora a principios de la década de los 70´s hasta la segunda mitad de la década de los 80´s, donde inician los cultivos comerciales. En la actualidad, casi la totalidad de las granjas comerciales de camarón en México producen camarón blanco, sin embargo, a finales de 2011 el Dr. Francisco Javier Magallón Barajas del Centro de Investigaciones Biológicas del Noroeste, transfirió a la empresa Algalimentos S.A. de C.V., la tecnología para la producción y desarrollo de larvas de camarón café a partir de organismos silvestres, además de desarrollar la tecnología para la domesticación del camarón café para la misma empresa. Para inicios de 2013 se logró reproducir todo el ciclo vital del camarón café en cautiverio, eliminando la necesidad de captura de organismos silvestres para la producción de larvas.
IV. INFORMACIÓN BIOLÓGICA
Distribución geográfica: Se distribuye en la región zoogeográfica del Pacífico oriental, desde Estados Unidos hasta Perú, incluyendo las Islas Galápagos y el Golfo de California.
Morfología: Cuerpo alargado, dividido en cefalotórax (rostro, antena, anténulas y periópodos), abdomen (6 segmentos abdominales y pleópodos) y cola (telson y urópodos), de coloración predominantemente gris translúcido con tonos oscuros marrones y rojizos. Tienen antenas, periópodos (patas delanteras) y urópodos (cola) pigmentados de color rojizo. Camarón peneido de télico cerrado.
Ciclo de vida: Desovan frente a las costas, a profundidades que varían aproximadamente de 10 a 80 metros. Los machos depositan en el télico de la hembra los espermatóforos durante la muda posteriormente la hembra expulsa los huevos (óvulos) los cuales son fecundados al salir de su cuerpo, los huevos eclosionan al término de unas horas liberando las larvas (nauplios, protozoeas, mysis).
Hábitat: Estuarios, lagunas costeras, plataforma continental y océano.
Alimentación en medio natural: Fitoplancton y zooplancton.
V. CULTIVO - ENGORDA
Biotecnología: Completa, sistema de cocultivo con macroalga Ulva clathrata en el cual se crea un micro ecosistema generando una cadena trófica, eficientizando y disminuyendo el uso de alimento balanceado, además de requerir bajo recambio de agua.
Sistemas de cultivo: Semi-intensivo con bajo recambio de agua.
Características de la zona de cultivo: Tierras costeras áridas con aguas frías de la Costa Occidental de Baja California.
Artes de cultivo: Estanques de tierra recubiertos con geomembrana de HDPE.
Promedio de flujo de agua para el cultivo: Se realiza en promedio de 5 a 10% de recambio de agua semanalmente en los estanques.
Densidad de siembra: 30 organismos por metro cuadrado.
Tamaño del organismo para siembra: PL 20-30.
Porcentaje de sobrevivencia: 80-85%.
Tiempo de cultivo: 25 a 30 semanas.
Tamaño promedio de cosecha: 16 a 20 g.
VI. PIE DE CRÍA
Origen: Nacionales.
Procedencia: Laboratorios privados en Baja California y Baja California Sur.
VII. ALIMENTO
El principal alimento del camarón durante la etapa de engorda es la macroalga Ulva clathrata y se complementa con alimento balanceado peletizado con 35% de proteína.
VIII. PARÁMETROS FÍSICO-QUÍMICOS
| PARÁMETRO
| INTERVALO ÓPTIMO
|
| Temperatura (°C)
| 22 - 26
|
| pH
| 7.5 - 9
|
| Oxígeno disuelto (mg/L)
| > 2
|
| Salinidad (ups)
| 35 - 40
|
| Nitrito (mg/L)
| <0.1
|
| Nitrato (mg/L)
| 0.4 - 0.8
|
| Amonio (mg/L)
| 0.1 a 1
|
IX. SANIDAD Y MANEJO
Importancia de la sanidad acuícola: Reducir la incidencia de enfermedades y agentes patógenos que afectan la producción, así como el control de parámetros fisicoquímicos para evitar el estrés.
Enfermedades reportadas: Virus de la mancha blanca (WSSV); Baculovirosis tetraédrica (Baculovirus penaei BP); Virus de la necrosis hipodérmica y hematopoyética infecciosa (IHHNV); Hepatopancreatitis necrotizante (NHP).
Buenas prácticas de producción acuícola: El objetivo es reducir riesgos en las unidades de producción y procesamiento primario de alimentos, tanto para disminuir la incidencia de enfermedades, asegurar la comercialización interna y de exportación. Mayor información: Manual de Buenas Prácticas en la Producción Acuícola de Camarón (https://www.gob.mx/cms/uploads/attachment/file/311356/ManualBPCam.pdf) o con los Comités de Sanidad Acuícola Estatales.
X. MERCADO
Presentación del producto: Fresco o congelado.
Precios del producto: $161 MXN/kg sin cabeza.
Mercado del producto: Internacional.
XI. INFORMACIÓN Y TRÁMITES
1. SEMARNAT: www.gob.mx/semarnat
2. CONAPESCA: www.gob.mx/conapesca
3. CONAGUA: www.gob.mx/conagua
4. SEMAR: https://www.gob.mx/semar
5. SCT: www.gob.mx/sct
XII. NORMATIVIDAD
Para esta especie no se cuenta con ninguna normatividad específica, para normatividad general consultar anexo.
XIII. MANEJO ECOSISTÉMICO
I. Certificación de la actividad camaronera en la región de Baja California.
II. Estimular el comercio para consumo nacional y extranjero.
III. Generar nuevos mercados (productos de calidad orgánica.).
IV. Asegurar la sustentabilidad, por lo cual es necesario: 1) marcos económicos, 2) institucionales y 3) legales, sólidos y eficaces.
V. Impulsar la creación de Unidades de Manejo Acuícola con sus respectivos planes de manejo, lo anterior para lograr el desarrollo, ordenado y sustentable de la acuacultura.
VI. Aprovechamiento de las tierras costeras áridas de la costa Occidental de la Península de Baja California y cuya temperatura del agua oceánica es ideal para el cultivo de esta especie de camarón.
XIV. INVESTIGACIÓN Y BIOTECNOLOGÍA
Genética: Actualmente está por iniciarse un proyecto de formación de pie de cría y mejoramiento genético.
Sanidad: Caracterización epidemiológica y patológica en poblaciones silvestres y cultivadas de camarón para la prevención de enfermedades.
Comercialización: Diseño de planes que promuevan el Análisis de Riesgo y Control de Puntos Críticos (HACCP, por sus siglas en inglés) para obtener productos de calidad y competitividad en el mercado tanto nacional como extranjero.
Tecnología de cultivo: Se busca la sustentabilidad por medio de unidades de cultivo que simulan el hábitat natural de la especie, recreando un micro-ecosistema en el cual se promueve el desarrollo y equilibrio de una cadena trófica donde hay una mayor eficiencia del flujo de nutrientes reduciendo significativamente el uso de alimentos balanceados.
XV. EFECTOS AMBIENTALES Y CAMBIO CLIMÁTICO
El cambio climático global conlleva además del incremento de la temperatura media del planeta, una serie de otras alteraciones que son potencialmente dañinas para la acuacultura, tales como: cambios en la temperatura del mar a nivel local, acidificación del océano, aumento en el nivel del mar, cambios en las concentraciones de oxígeno ambiental, incremento en la fuerza y frecuencia de tormentas, cambios en los patrones de circulación de corrientes marinas, cambios en los patrones de lluvias, cambios en los caudales de los ríos y cambios en los flujos biogeoquímicos.
Estos cambios traerán repercusiones en los ecosistemas, las sociedades y las economías y se piensa que a raíz de esto aumentará la presión sobre los medios de vida y el suministro de alimentos, incluidos los alimentos que provienen del sector acuícola.
Como medidas de adaptación ante estos cambios, se recomienda lo siguiente:
I. La creación de seguros contra pérdidas o desastres provocados por fenómenos climáticos.
II. Llevar a cabo investigaciones específicas para adaptar las actividades acuícolas al cambio climático.
III. Crear mecanismos de transferencia de tecnología que puedan a los acuacultores, especialmente a los pequeños empresarios.
IV. Mejorar la selección de crías para conseguir la tolerancia a temperaturas más altas.
V. Mejorar la planificación y el emplazamiento de las instalaciones, ajuste al cambio climático, regulación del seguimiento.
VI. Remplazo de la harina y aceite de pescado, nuevas formas de procesamiento de alimentos y adopción de productos no carnívoros.
Prevención y seguir las normas sanitarias para prevenir riesgos sanitarios.
XVI. ESTADÍSTICAS DE PRODUCCIÓN
No se disponen cifras oficiales para el cultivo de esta especie.
5. ESPECIES CON PROTECCIÓN ESPECIAL
5.1 Ajolote
I. GENERALIDADES
Nombre común: Axolotl, ajolote mexicano o ajolote de Xochimilco.
Nombre científico: Ambystoma mexicanum (Shaw and Nodder, 1798).
Nivel de dominio de la biotecnología: Incompleto.
Origen: Especie endémica del lago de Xochimilco, cuenca del valle de México.
Estatus del cultivo: Completo.
Mercado: Nacional e Internacional.
Limitantes técnico-biológicas de la actividad: Costos de producción hacen difícil incursionar en la industria de alimento manteniéndose únicamente como ornato.
II. ENTIDADES DE CULTIVO
En Unidades de Manejo para la Conservación de la Vida Silvestre (UMA).
III. ANTECEDENTES DE LA ACTIVIDAD
Desde 1863 el general francés Elie Frédéric Forey envió al Museo de Historia Natural de París, 34 ejemplares vivos de Ajolote Mexicano llevados desde Xochimilco. El zoólogo Auguste H. A. Duméril recibió, y estudió a los ajolotes realizando los primeros estudios científicos y logrando su reproducción en cautiverio, además se encargó de enviar ejemplares a varios países de Europa y eventualmente a otros continentes.
A más de 150 años y debido a la relativa facilidad con la que se pueden criar en cautiverio, los Ajolotes Mexicanos se encuentran hoy en acuarios y laboratorios de todo el mundo en los cuales se han realizado un gran número de estudios en importantes campos de la ciencia. Las investigaciones abarcan áreas como la biología celular, anatomía, genética y evolución, entre otras.
IV. INFORMACIÓN BIOLÓGICA
Distribución geográfica: Actualmente, en vida libre se encuentra en el sistema de canales de Xochimilco en la Ciudad de México, en los lagos de Texcoco y Chalco, también se encuentran distribuidos por Tlaxcala, en el municipio del Carmen Tequexquitla. Su hábitat son lagos o canales de aguas poco profundas con mucha vegetación acuática.
Morfología: El ajolote es una salamandra y anfibio que no presenta metamorfosis; alcanza la madurez sexual y puede reproducirse sin perder las características físicas y morfológicas de su estado larvario (esta característica se conoce como neotenia). Este anfibio "de la eterna juventud" permanece en un medio acuático toda su vida y es capaz de regenerar todas las partes de su cuerpo, incluido el sistema nervioso, situación que lo ha hecho muy atractivo para científicos de todo el mundo.
Es de color verdoso y marrón, su piel es lisa en casi todo el cuerpo, aunque puede ser ligeramente rugosa y con pequeños poros que solo se aprecian de cerca. Las características distintivas incluyen una cabeza robusta, plana y ancha, sus ojos son pequeños y sin párpados, aletas caudales y tres pares de branquias en la superficie anterior del arco branquial.
Su cabeza más ancha que larga, mide de 3.3 a 3.7 cm. Pesan de 60 a 110 g, y en promedio 85 g. Su boca es grande y tiene alrededor de 126 pequeños dientes maxilares y premaxilares, y de 18 a 20 dientes vomero-palatinos que están ubicados dentro de la cavidad de la boca. Su lengua es retráctil. El cuerpo tiene 12 pliegues de cada lado. Una característica distintiva son los tres pares de branquias externas y ramificadas que salen hacia atrás de la base de la cabeza. A la altura de sus branquias, en el dorso, tiene una membrana rígida que se prolonga por toda la cola formando una aleta.
Su cola es aplanada lateralmente y tiene una coloración verde olivo, con una mezcla de tonalidades marrones y pardas. En las extremidades y la región ventral la coloración es más pálida que en el resto del cuerpo. Es común encontrar especímenes con hendiduras en la parte de la cabeza y el dorso las cuales son producto de glándulas mucosas en la piel.
Las extremidades anteriores y posteriores tienen una membrana interdigital que le permite desplazarse
con mayor facilidad en el agua. Las patas tienen dedos finos y puntiagudos que no desarrollan uñas, cuatro dedos en las patas anteriores y cinco en las posteriores. La aleta dorsal caudal comienza en un punto de la línea media dorsal, a nivel de las extremidades anteriores, siendo continua hasta la punta de la cola. El tamaño total en promedio es de 23 a 25 cm.
Ciclo de vida: Los ajolotes no son renacuajos, sino salamandras. Al salir del huevo, las salamandras desarrollan rápidamente sus patas y enseguida se parecen a los adultos; sus branquias son ramificadas, visibles en todo momento y las ostentan a ambos lados de la cabeza; además, suelen ser carnívoros como los adultos.
El ajolote es un anfibio, que conserva su forma larval en la edad adulta, es decir que es un organismo maduro sexualmente con la forma de una larva y tiene fertilización interna. Esta adaptación de mantener la forma de larva en la edad adulta se le conoce como neotenia, esta característica evita que el achoque viva en tierra, y en consecuencia no pueda transformarse en salamandra y no pueda colonizar otro hábitat. En esta especie la madurez sexual se alcanza aproximadamente al año de edad. Antes del año no se pueden diferenciar, hembras y machos. Los machos se pueden distinguir por su cloaca (orificio reproductivo y excretorio) más abultada que la de la hembra.
Se reproduce en la estación invernal, una sola vez al año. El apareamiento se realiza después de un breve cortejo, en el que al principio, juntan la región de las cloacas, para después realizar una especie de baile lento, moviéndose en círculos. El macho se aparta mientras mueve de forma ondulada la parte posterior de su cuerpo y cola, mientras la hembra lo sigue. Posteriormente, el macho agita vigorosamente la cola por aproximadamente medio minuto, al hacer esto libera una masa gelatinosa con una cubierta de esperma en forma de cono, llamada espermatóforo y continúa moviéndose hacia adelante; la hembra se desliza sobre el espermatóforo absorbiéndolo con la cloaca.
Aproximadamente 24 horas después de la fecundación, la hembra libera entre 600 y 1,500 huevos fecundados, los cuales deposita paulatinamente, tardando a veces, hasta tres días. No construye madrigueras, pero tiene tendencia a poner huevos prefiriendo vegetación con raíces esponjosas y densas donde están más protegidos. Eclosionan después de 11 a 15 días, y las larvas pueden madurar sexualmente al cumplir el año, aunque esto varía según el individuo.
El ciclo de vida del ajolote se lleva a cabo en 5 etapas:
Etapa 1.- El huevo mide entre 2 y 4 milímetros de diámetro, abarca el embrión y una sustancia que se secreta alrededor del mismo.
Etapa 2.- El embrión sigue dentro del huevo en estadio de "yema caudal", el embrión mide aproximadamente 7 mm de longitud y gira en el interior de su cámara capsular por la acción de los numerosos cilios que recubren todo su tegumento. Al final de la primera semana son visibles algunos de los órganos. Se comienzan a ver manchas pigmentadas que indican los esbozos de los ojos, aparece una depresión que muestra el emplazamiento de la futura boca y detrás de cada ojo una serie de tres crestas verticales que representan los rudimentarios arcos branquiales. En el transcurso de la segunda semana aparecen tres branquias rudimentarias sobre los arcos branquiales, mientras que en la zona inferoposterior de cada ojo se forma una evaginación corta y claviforme la cual dará lugar a un órgano llamado "balancín". También la cola se ha aplanado lateralmente y, aunque todavía sigue enrollada alrededor del cuerpo en el interior de la cubierta del huevo, ésta ya tiene movimientos esporádicos. A la tercera semana se ha formado el corazón que comienza a latir. Al final de la tercera y principios de la cuarta semana se produce la eclosión por la secreción de un complejo glandular situado sobre el hocico.
Etapa 3.- Sale del huevo y se convierte en larva, transparentes hasta que la piel se engruesa y las células del pigmento proliferan sobre el cuerpo.
Etapa 4.- En la quinta y sexta semana se desarrollan las extremidades delanteras primero y tiempo después las extremidades traseras.
Etapa 5.- Ya es un adulto en miniatura; en el intervalo entre 18 meses y dos años alcanzará la talla promedio de 23 a 25 centímetros dependiendo de su alimentación y temperatura.
Hábitat: Zonas lacustres, canales fangosos y ambientes pantanosos.
Alimentación en el medio natural: Su dieta es amplia, come pequeños peces, renacuajos, insectos acuáticos, lombrices, crustáceos y moluscos de agua dulce. Cuando son larvas pequeñas se alimentan de zooplancton, formado por crustáceos microscópicos como copépodos, cladóceros (pulgas de agua: Moina macrocopa, Simocephalus vetulus, Coronatella rectangula, Macrothrix triserialis.) y rotíferos (animales microscópicos de no más de 0.5 mm de largo con aparato bucal complejo) como Brachionus spp. En cautiverio pueden comer una gran variedad de cosas, incluyendo croquetas especiales para tortugas, grillos, tubifex, artemias, tenebrios (larvas de escarabajo) y hasta pollo. Su forma de atrapar el alimento es por medio de succión repentina, utiliza sus pequeños dientes para retener a su presa, la cual traga completa. Este movimiento repentino empuja al ajolote hacia atrás y arriba, para luego posarse en el fondo de nuevo. Son caníbales.
V. CULTIVO - ENGORDA
Biotecnología: Es una especie fácilmente adaptable al cautiverio con alto potencial reproductivo, lo que le permite ser considerada con potencial acuícola. Se dispone del ciclo cerrado en algunas Unidades de Manejo para la Conservación de la Vida Silvestre (UMA). Los puntos críticos y esenciales a considerar durante el manejo de los diferentes contenedores son: a) Alimentación, b) Limpieza y desinfección, c) Diseño de infraestructura, d) Manejo de filtros y bombas de aire, e) Cambio de agua y límite de llenado y, f) Densidad de población, g) temperatura.
Sistemas de cultivo: Intensivo.
Características de la zona de cultivo: Para la producción en cautiverio se recomiendan recipientes de fondo plano, con capacidad de 20 litros; para los adultos se emplean contenedores de mayor capacidad, colocados en parejas o hasta seis individuos. Para la ambientación de los albergues donde se llevará a cabo la reproducción, colocar sustratos como grava y rocas; también se pueden colocar plantas acuáticas, como cola de zorra y escondites, ya sean naturales o artificiales, usando por ejemplo rocas huecas, tejas de barro o tubos de PVC; los anfibios son sumamente sensibles a los desequilibrios que se presentan en su sistema. Sobre todo, en los cambios repentinos de temperatura, cambios en la alimentación y alteraciones en los factores físico químicos del agua, como aumento o disminución del pH, amonio, nitrito y nitratos.
Artes de cultivo: Acuarios, tinas, estanques o recipientes de diferentes capacidades.
Promedio de flujo de agua para el cultivo: Depende mucho de las distintas etapas de vida, en etapa de larvas no es recomendable tener flujo en los recipientes ya que se adiciona alimento vivo, el cual se perdería. A partir de los 3 o 4 meses de edad puede incluirse un flujo moderado en los contenedores hasta etapa adulta, aunque durante los eventos reproductivos no es recomendable.
Densidad de siembra: Realizar dos cambios parciales de agua por uno total, a intervalos de 15 a 20 días. Este último deberá incluir la limpieza y desinfección del contenedor y el equipo utilizado como filtro (grava, plantas artificiales etc.). La recomendación anterior es para contenedores de 40 litros con filtro sencillo, grava, con una densidad de 4 a 6 ajolotes adultos y rutinas de alimentación, dando tubifex diariamente y acociles tres veces por semana en cantidades adecuadas y según la demanda.
Tamaño del organismo para siembra: La talla que adquieran las larvas después de la eclosión (entre 15 días y un mes) es variable. El tamaño adecuado para la siembra tendría que ser entre los 3 a 5 meses de edad, con una talla de entre los 15 a 17 cm. La siembra puede ser en tanques, acuarios o tinas para su cultivo.
Porcentaje de sobrevivencia: Para evitar la mortalidad actualmente se sugiere mantener 20 individuos de 90 días de nacidas, por contenedor de 20 litros, o bien 40 individuos si el contenedor es de 40 litros; esta medida, más la realización de sifoneos, cambios parciales de agua y una buena alimentación, disminuirá de forma considerable la presencia de enfermedades. En condiciones óptimas cerca del 80%.
Tiempo de cultivo: La ovoposición consta de cientos de huevos por puesta, dependiendo de la edad de la hembra. El tiempo de incubación de los huevos dependerá de la temperatura ambiental, pero normalmente puede oscilar entre los 12 y los 18 días. En sistemas intensivos el periodo es cercano a 12 meses promedio.
Tamaño promedio de cosecha: Dependerá de la demanda en el mercado, el juvenil suele tener más demanda (10 a 15 cm).
VI. PIE DE CRÍA
Origen: Nacional.
Procedencia: Unidad de Manejo para la Conservación de la Vida Silvestre (UMA) y Predios o instalaciones que manejan vida silvestre en forma confinada, fuera de su hábitat natural (PIMVS).
VII. ALIMENTO
El primer alimento para larvas es zooplancton vivo después del tercer día cuando haya absorbido el saco vitelino hasta los 4 meses de edad. Después de este tiempo se les puede alimentar con tubifex, peces pequeños, lombriz de tierra y acociles.
VIII. PARÁMETROS FÍSICO-QUÍMICOS
| PARÁMETRO
| MÍN
| MÁX
|
| Temperatura ºC | 15
| 22
|
| Oxígeno disuelto (mg/l) | 5
|
| Ph | 6.5
| 7
|
| Amonio (mg/l) | 0
|
| Alcalinidad (mg/l) | 300
|
IX. SANIDAD Y MANEJO
Importancia de la sanidad acuícola: El principal problema que enfrentan las crías para sobrevivir ocurre normalmente entre la cuarta y la sexta semana de crecimiento. En este periodo las crías son más susceptibles a la presencia de enfermedades que provocan alta mortalidad. Los posibles agentes infecciosos que ocasionan la enfermedad pueden ser de tipo fúngico, protozoarios o ectoparásitos del tipo de los oodinoides, que atacan la piel debilitándola y favoreciendo la presencia de enfermedades secundarias. Para disminuir o prevenir la presencia de cualquier tipo de enfermedad en las crías se sugiere mantener una buena calidad del agua, buena alimentación y evitar la sobrepoblación en los contenedores, pues provoca un aumento en la concentración de amonio, originado por la excreción de orina y heces de los individuos; esto, junto con el alimento muerto no consumido o degradado, disminuye la calidad del agua, incrementa el estrés y provoca mortalidad.
Enfermedades reportadas: Enfermedades causadas por bacterias como: pseudomonas causantes de septicemia hemorrágica, aeromonas causante de la furunculosis, mycobacteria causante de una enfermedad análoga a la tuberculosis y myxobacteria la cual produce la enfermedad de las branquias, la cual se asocia a problemas de estrés ambiental y es iniciada por altos niveles de sólidos suspendidos; adicionalmente, los ajolotes sufren de chytridiomycosis, una enfermedad en la piel asociada a los anfibios y producida por un hongo que es difícil de erradicar, y que ha infectado incluso poblaciones de laboratorio y acuario.
Buenas prácticas de producción acuícola: El objetivo es reducir riesgos en las unidades de producción y procesamiento primario de alimentos, tanto para disminuir la incidencia de enfermedades, asegurar la comercialización interna y de exportación.
X. MERCADO
Presentación del producto: Una especie que tiene demanda en diferentes sectores, se utiliza principalmente como ornato y para investigación en diferentes ramas de la medicina dada sus capacidades de regeneración, sin embargo ha formado parte importante de la cultura y tradiciones, su carne se consume fresca o seca al sol, en diferentes platillos (Llamas, 1935).
Precios del producto: Su valor más alto se presenta como especie de ornato dónde alcanza de $300 a $500 MXN en etapa juvenil hasta los $ 1500 MXN en reproductores.
Mercado del producto: Gracias a la difusión en redes sociales y a compras realizadas por internet de varias UMA autorizadas, se ha vuelto un organismo con gran aceptación no solo a nivel nacional sino también a nivel internacional, en donde según datos de CITES del 2009 a 2019, se han comerciado un promedio de 1,379 ejemplares criados en cautiverio por año. Los principales propósitos del comercio fueron científicos (58%), económicos (23%) y médicos (19%). Los principales países que exportaron los ejemplares fueron Estados Unidos (56%), Austria (17%) y la República Checa (16%). En este periodo, para esta especie endémica a México, nuestro país exportó anualmente un promedio de 3.3 ejemplares, que representa el 0.2% del comercio internacional anual.
XI. INFORMACIÓN Y TRÁMITES
Para el cultivo de esta especie se debe realizar el registro correspondiente como Unidad de Manejo para la Conservación de la Vida Silvestre ante la SEMARNAT.
I. SEMARNAT: www.gob.mx/semarnat
II. CONAPESCA: www.gob.mx/conapesca
III. SENASICA: www.gob.mx/senasica
IV. COFEPRIS: www.gob.mx/cofepris
V. CONAGUA: www.gob.mx/conagua
XII. NORMATIVIDAD
Debido a que es una especie endémica de México y en peligro de extinción "P" (NOM-059-SEMARNAT-2010), además de considerar anexo normatividad general, revisar la siguiente normativa específica para la especie:
Norma Oficial Mexicana NOM-059-SEMARNAT-2010, Protección ambiental-Especies nativas de México de flora y fauna silvestres-Categorías de riesgo y especificaciones para su inclusión, exclusión o cambio-Lista de especies en riesgo.
Así mismo la especie se encuentra listada en el Apéndice II de la CITES, por lo cual su comercio internacional se permite, pero se regula. Si se pretende exportar, se requiere cumplir con la definición de cría en cautiverio de la Resolución 10.16 (Rev.) de la CITES, que en términos generales implica la reproducción en ciclo cerrado hasta obtener especímenes de segunda generación.
XIII. MANEJO ECOSISTÉMICO
Esta información está en actualización.
XIV. INVESTIGACIÓN Y BIOTECNOLOGÍA
Desarrollo tecnológico: Para la alimentación de los organismos con alimento vivo, como tubifex.
Sanidad y Tecnología de alimentos: En proceso de investigación.
Comercialización: los productores realizan la venta directa. No se permite la adquisición de ejemplares de esta especie en el mercado negro, así como extraerlos de su hábitat natural.
XV. EFECTOS AMBIENTALES Y CAMBIO CLIMÁTICO
La especie se cultiva en ecosistemas acuáticos continentales, donde los ciclos de producción siguen muy de cerca los cambios estacionales de la temperatura y las lluvias en el entorno terrestre circundante que crea un medio ambiente dinámico, donde la disponibilidad de hábitats acuáticos se modifica constantemente y los nutrientes se liberan intermitentemente, y los cuales se ven impactados por los efectos de los usos de tierras por el ser humano.
Debido al cambio climático, este tipo de ecosistemas se ven afectados por:
I. La variación en las precipitaciones anuales, tienen un impacto directo en la perdurabilidad de los ambientes acuáticos afectando el tiempo de residencia del agua, ya que los niveles y caudales de la mayoría de ríos, lagos, embalses y humedales se vinculan a la precipitación a corto plazo de modo muy directo.
II. La temperatura del agua está directamente relacionada con el aumento de la temperatura global del aire causado por el efecto del aumento de Gases Efecto Invernadero en la atmósfera.
III. Los aumentos de temperatura harán ascender la nitrificación de los suelos y, por escorrentía, el nitrato en los ríos. Teniendo el mismo efecto en el nitrógeno orgánico en cuencas predominantemente agrícolas.
XVI. ESTADÍSTICAS DE PRODUCCIÓN
No existen estadísticas de producción por parte de la autoridad.
5.2 Caballito de mar del Atlántico
I. GENERALIDADES
Nombre común: Caballito de mar listado o estriado.
Nombre científico: Hippocampus erectus Perry, 1810.
Nivel de dominio de la biotecnología: Esta especie ha sido criada en cautiverio con éxito, convirtiéndola en una buena candidata para la acuacultura.
Origen: Al parecer el género Hippocampus es originario del Indo Pacífico y tiene una antigüedad de al menos 20 millones de años. Hippocampus erectus parece haber colonizado las aguas del Atlántico Occidental por dispersión (Teske et al., 2004, 2007).
Estatus del cultivo: Experimental y piloto comercial, así como de producción a mayor escala, esto último principalmente en Países Asiáticos, Australia, Nueva Zelanda, el Sur de África y Estados Unidos (Wilson, 1999).
Mercado: Tienen una creciente demanda en el mercado mundial como organismo de ornato en la acuarofilia, así como souvenirs en diferentes partes del mundo. Se ha estimado que de 2004 a 2008 se comercializó un promedio de 10 millones de caballitos de mar secos y 120 mil vivos por año (Vincent et al., 2011).
Limitantes técnico-biológicas de la actividad: El cultivo de estos organismos es particularmente difícil, principalmente en su etapa temprana de desarrollo, básicamente por la necesidad de una variedad de alimentos vivos, así como por su vulnerabilidad a las enfermedades (Wilson, 1998; Koldewey, 2010).
II. ENTIDADES DE CULTIVO
Yucatán
III. ANTECEDENTES DE LA ACTIVIDAD
El cultivo de los caballitos de mar inició en la década de los 70's, y 20 años después esta actividad seguía plagada de problemas, principalmente en los aspectos de alimentación y control de enfermedades. A inicios del año 2000 se registró una expansión considerable del número y tamaño de sitios de operación, así como del número de especies cultivadas; aunque esto contribuyó a satisfacer el comercio de hipocampos para acuarios, no fue así para satisfacer el de la medicina tradicional china. En la actualidad dentro del género Hippocampus, H. erectus se encuentra entre las especies más comercializadas, especialmente para acuarios ornamentales, como artesanías y en la medicina tradicional china.
IV. INFORMACIÓN BIOLÓGICA
Distribución geográfica: En el Atlántico Occidental H. erectus y H. reidi, presentan una amplia distribución desde Estados Unidos (H. erectus posiblemente desde Canadá) hasta Brasil (Lourie et al., 2004).
Morfología: El caballito de mar posee una estructura alargada, constituida por segmentos de anillos que recubren sus placas óseas, las cuales se mantienen unidas y culminan en la parte inferior de su cuerpo a manera de espiral en lo que sería su cola. La cabeza tiene forma alargada y se extiende para constituir un "hocico" tubular que se asemeja a la cabeza y hocico de un caballo (de aquí el nombre de "caballito de mar"). Su boca carece de dientes. Cabe destacar que su cuerpo presenta una rigidez que les impide nadar como lo hacen comúnmente otras especies de peces, por lo que el caballito de mar se desplaza con movimientos en una posición erguida, todo esto con ayuda de su aleta dorsal, la cual impulsa todos sus movimientos horizontales, ya que carecen de aletas caudal y ventral. Aunque se conocen por nadar de manera pausada y lenta, estos peces tienen la capacidad de camuflagearse, cambiando las tonalidades de su piel, para protegerse de sus depredadores. El caballito de mar presenta características únicas en su anatomía, entre las cuales se encuentra el hecho de tener su cabeza en un ángulo recto con su cola, lo cual no se ha visto en ninguna otra especie de peces; igualmente es única su cola en forma de espiral que le permite amoldarse a los corales y sostenerse de algunas plantas acuáticas; en los casos de las especies más pequeñas, esto constituye una eficaz herramienta para mantenerse firme cuando se intensifican las corrientes de agua. (www.HablemosDePeces.com/caballito-de-mar/).
Ciclo de vida: Un macho puede ser visitado por cierto número de hembras que le dejan huevos en su bolsa incubatriz, pudiendo dar a luz a más de 400 organismos. Los primeros días las crías entrarán y saldrán de la bolsa dependiendo del peligro en el exterior. Los caballitos de mar juveniles son muy vulnerables a los depredadores, los adultos por otro lado no tienen muchos, probablemente por su capacidad de camuflaje. Se han encontrado en estómagos de grandes peces pelágicos tales como el atún, la castañeta roja, etc. Otro factor natural a tener en cuenta son las tempestades, las cuales pueden trastornar seriamente sus poblaciones, arrojando a algunos a tierra y a otros a la deriva, dando lugar, de éste modo, a la muerte de muchos adultos.
El tiempo de gestación de H. erectus fluctúa entre 12 a 22 días en cautiverio y su intervalo de fecundidad se estima en: 97-1552 (Teixeira y Musick, 2001), 189-362 (Lin et al, 2008b). Su talla al nacer: 8-12 mm (Lin et al, 2008b). Los nuevos caballitos son una réplica en miniatura de los adultos con capacidad de alimentarse desde que son expulsados.
Hábitat: Una característica principal es que la temperatura debe ser elevada, es común encontrarlos en las aguas tropicales, en la mayoría de los casos habitan aguas someras donde la vegetación es abundante, aunque se han encontrado casos que alcanzan hasta 70 m de profundidad. Esta especie es común en zonas costeras, lagunas y estuarios, donde abundan las praderas de Thalassia spp., Zostera spp. y Sargassum sp. en el caso particular de Chelem, Yucatán, se localiza generalmente en fondos en los que predominan pastos marinos como Halodule spp., Syringodium spp. y algas como la Dasycladus spp. y Halimeda spp. Estos organismos son muy vulnerables a los cambios de hábitat distintos a las condiciones de su entorno, por lo que en el caso de su extracción del medio natural es fundamental mantener las condiciones adecuadas de parámetros físico-químicos, principalmente la temperatura. El hábitat influye en su desarrollo, cambiando aspectos como tamaño, color y forma, pueden desarrollar nuevos filamentos de piel para adaptarse mejor a las condiciones del entorno cuando su hábitat se modifica. (www.HablemosDePeces.com/caballito-de-mar).
Alimentación en medio natural: Es un depredador de pequeñas especies de invertebrados que conforman el zooplancton, principalmente crustáceos, los cuales aspira por medio de su hocico óseo y se los tragan enteros, ya que carecen de dientes. Sus ojos tienen una movilidad de forma independiente lo que les permite tener una amplia visión e identificar a sus presas.
V. CULTIVO - ENGORDA
Biotecnología: Incompleta. El establecimiento de un cultivo exitoso de estos peces requiere protocolos de trabajo bien planeados y estructurados, con base en el conocimiento científico disponible.
Sistemas de cultivo: Lo más utilizado para el mantenimiento en cautiverio son los sistemas cerrados de recirculación de agua. Un sistema de recirculación de agua con biofiltros y esterilización con lámparas de ultravioleta u ozono, permite mantener la calidad de agua cuando las condiciones marinas sean adversas (contaminación u otras), además de ser un "seguro" de la inversión de cultivo.
Para llevar a cabo la cría de los organismos recién nacidos de H. erectus se emplea un sistema de recirculación con peceras de vidrio de 11 L similar al que se emplea en la cuarentena, el cual posee un reservorio que mantiene sistemas de filtración mecánica y biológica de la misma forma a los descritos para los reproductores.
Las siguientes características, compiladas por López, 2019, se han recomendado para los tanques de reproductores:
Tamaño: 432 L (Lin et al. 2008, 2009a, 2009b); 45-53 cm de altura para permitir la transferencia de huevos, de preferencia 80-100cm (Koldewey, 2005); sistema de recirculación de varias peceras de vidrio de 100 L c/u (50x28x71cm) conectadas a reservorio de 145 L (71x51x40cm) (PIECEMO, 2013); Mínimo 90 y altura 70 cm de altura para columna de agua a (Planas-Oliver et al., 2017).
Características de la zona de cultivo: Se utilizan peceras de vidrio.
Artes de cultivo: Peceras de vidrio de 11 L. Dependiendo de la disponibilidad de espacio y únicamente si es necesario, las crías pueden ser trasladadas a estanques de 100 L una vez que alcanzan los dos meses de edad. Faleiro & Narciso (2013b) recomiendan una altura del estanque para reproductores de al menos cinco veces la altura de los caballitos de mar.
Promedio de flujo de agua para el cultivo: Los recambios de agua dependen en gran medida de la carga biológica presente en el sistema desde 25% semanal (Wilson et al., 2006) hasta un recambio diario de 20% (Novelli et al., 2015) a 30-50% (Buen-Ursua et al., 2015), por lo que es importante mantener un monitoreo constante de la calidad del agua, sobre todo si se quiere lograr el cultivo a escala comercial.
Densidad de siembra: Es recomendable una densidad no mayor a tres individuos por litro durante los 25 primeros días de vida, posteriormente reducirla a dos juveniles para evitar mortalidad. Por otro lado, existen algunos reportes de densidades que han alcanzado los 25 individuos por litro.
Tamaño del organismo para siembra: De 8 a 12 mm recién nacidos.
Porcentaje de sobrevivencia: 82% alimentados con Artemia enriquecida con ADH-Selco y 49% alimentados con Artemia sin enriquecimiento.
Tiempo de cultivo: 9 semanas.
Tamaño promedio de cosecha: Entre 15 y 20 cm.
VI. PIE DE CRÍA
Origen: Nacional
Procedencia: De Unidades de Manejo para la Conservación de Vida Silvestre.
VII. ALIMENTO
El alimento vivo como rotíferos y Artemia enriquecido con mezclas de ácidos grasos, aminoácidos, vitaminas, minerales y otros elementos, permite tener buenos resultados en crecimiento y supervivencia, además con este tipo de alimento se puede proyectar una producción a mayor escala.
La demanda nutricional está basada en elementos con un nivel adecuado de ácidos grasos altamente insaturados y una relación apropiada de EPA: DHA (2:1); un aporte balanceado similar al que se presenta en los organismos en su dieta natural. Individuos criados en acuarios, se pueden acostumbrar a comer alimento inerte (congelado), lo cual hace más práctico desde el punto de vista económico e infraestructura operativa. Los recién nacidos de escasos milímetros de tamaño, sólo se alimentarán de fitoplancton (microalgas), hasta que el diámetro de su boca, le permita ingerir otro tipo de alimentos.
VIII. PARÁMETROS FÍSICO-QUÍMICOS
Se considera una especie tolerante a un amplio intervalo de temperatura (5 a 30°C) y de salinidad (10 a 36.6 ups), se recomienda un fotoperiodo 12:12.
| PARÁMETRO
| INTERVALO ÓPTIMO
|
| Temperatura (°C)
| 24 - 26 °C
|
| Ph
| 8.2
|
| Salinidad (ups)
| 25 - 35
|
| Nitritos (mg/L)
| 0.3
|
| Nitratos (mg/L)
| 12.5
|
| Amonio (mg/L)
| 0
|
IX. SANIDAD Y MANEJO
Importancia de la sanidad acuícola: Al igual que muchas especies de peces en cultivo, los caballitos de mar son susceptibles a enfermedades, principalmente si se les mantiene en grandes densidades o en condiciones de cultivo sub-óptimas, lo cual los hace más vulnerables.
Enfermedades reportadas: Se han reportado enfermedades de diversos tipos, entre ellas están las causadas por parásitos (externos e internos), hongos, virus y bacterias; particularmente comunes son la vibriosis y mycobacteriosis (Koldewey, 2010).
Buenas prácticas de producción acuícola: Establecimiento de protocolos de cultivo que involucren desde la ingeniería y diseño de los sistemas hasta un trabajo rutinario de limpieza y mantenimiento de estanques o acuarios, la adquisición y/o suministro constante y seguro de alimento de calidad, frecuencias de alimentación, densidades adecuadas para cada etapa de crecimiento y un adecuado manejo de reproductores y juveniles. Es importante mantener un monitoreo constante de la calidad del agua, sobre todo en el cultivo a escala comercial.
X. MERCADO
Presentación del producto: Desecado (para uso medicinal) y vivo (para acuarios).
Precios del producto: Dependiendo de la presentación del producto, seco alcanza entre $500 a $1,500 MXN por kg, mientras como especies de ornato por individuo puede oscilar entre los $1,998.80 a los $2,618.50 pesos por individuo en el mercado internacional.
Comercio internacional: A nivel internacional del 2009-2019 se han comerciado un promedio de 158 ejemplares criados en cautiverio por año (trade.cites.org). Los principales propósitos del comercio fueron económicos (93%). Los principales países que exportaron los ejemplares fueron Estados Unidos (91%), Reino Unido (2%) y la República Checa (2%). En este periodo, para ésta especie nativa a México, nuestro país no reporta comercio internacional criado en cautiverio (trade.cites.org).
XI. INFORMACIÓN Y TRÁMITES
Para el cultivo de esta especie se debe realizar el registro correspondiente como Unidad de Manejo para la Conservación de Vida Silvestre ante la SEMARNAT.
I. SEMARNAT: www.gob.mx/semarnat
II. CONAPESCA: www.gob.mx/conapesca
III. SENASICA: www.gob.mx/senasica
IV. COFEPRIS: www.gob.mx/cofepris
V. CONAGUA: www.gob.mx/conagua
XII. NORMATIVIDAD
Además de considerar anexo normatividad general, revisar la siguiente normativa específica para la especie considerando que se encuentra en la categoría de riesgo como especie sujeta a protección especial (Pr).
Norma Oficial Mexicana NOM-059-SEMARNAT-2010, Protección ambiental-Especies nativas de México de flora y fauna silvestres-Categorías de riesgo y especificaciones para su inclusión, exclusión o cambio-Lista de especies en riesgo.
La especie se encuentra listada en el Apéndice II de la CITES, por lo cual su comercio internacional se permite, pero se regula. Si se pretende exportar, es necesario cumplir con la definición de cría en cautiverio de acuerdo a la Resolución 10.16 (Rev.) de la CITES, que en términos generales implica la reproducción en ciclo cerrado hasta obtener especímenes de segunda generación.
XIII. MANEJO ECOSISTÉMICO
Los caballitos de mar, al igual que la gran mayoría de las poblaciones marinas, han sido afectados por la degradación de los ambientes costeros que habitan. Así mismo, la creciente demanda en el mercado mundial ha llevado a la sobreexplotación, con repercusiones significativas de las poblaciones locales de las zonas tradicionales de pesca (Vincent, 1996; Kuiter, 2000; Perry et al., 2010; Foster et al., 2014). Para mitigar este problema, y fomentar un comercio internacional sostenible; todas las especies de caballito de mar fueron incluidas en el Apéndice II de la Convención sobre el Comercio Internacional de Especies Amenazadas de Fauna y Flora Silvestres en la 12va Conferencia de las Partes de la CITES, entrando en vigor en el 2004 (CITES, 2002; Vincent et al., 2014). Por ello, el cultivo representa, no solo una oportunidad de negocio, sino una medida para la conservación y uso sostenible de estas especies.
XIV. INVESTIGACIÓN Y BIOTECNOLOGÍA
Desarrollo tecnológico: Profundizar en temas como la frecuencia reproductiva a largo plazo. Los efectos de la nutrición de reproductores en el desempeño de su descendencia, el efecto de parámetros físico-químicos sobre los parámetros reproductivos, así como los criterios de calidad de ovocitos y juveniles (bioquímicos y morfológicos), entre otros aspectos reproductivos.
Sanidad: Al igual que muchas especies de peces en cultivo, los caballitos de mar son susceptibles a enfermedades, principalmente si se les mantiene en grandes densidades o en condiciones de cultivo sub-óptimas, lo cual los hace más vulnerables.
Comercialización: Especialistas de la Unidad Académica Sisal de la Universidad Nacional Autónoma de México (UNAM), lograron desarrollar con éxito un paquete tecnológico para la crianza y reproducción de los caballitos de mar o hipocampos con fines de comercialización. Este proyecto forma parte de los programas de cultivo de peces de ornato que puedan tener un interés comercial dentro y fuera de las fronteras mexicanas.
Tecnología de alimentos: Son escasos los estudios, hace falta información al respecto.
XV. EFECTOS AMBIENTALES Y CAMBIO CLIMÁTICO
No se tiene documentado de forma específica el impacto del cambio climático sobre las poblaciones de caballitos de mar, sin embargo, están siendo afectadas por la degradación de los ambientes costeros que habitan.
XVI. ESTADÍSTICAS DE PRODUCCIÓN
No se disponen cifras oficiales.
5.3 Caballito de mar del Pacífico
I. GENERALIDADES
Nombre común: Caballito de mar del Pacífico.
Nombre científico: Hippocampus ingens Girard, 1858.
Nivel de dominio de la biotecnología: Se conoce que no presentan periodos reproductivos, obteniendo
nacimientos exitosos a lo largo de todo el año (Ortiz-Aguirre, 2018). Se ha demostrado que la calidad del alimento ofrecido a los reproductores juega un papel importante en la supervivencia de los alevines, así como en la calidad de los ovocitos secundarios, indicando que hace falta profundizar en el tema (Sandoval-Muy, 2006; Sandoval-Muy & Barón, 2007; Encomendero et al., 2011), denotando a su vez, la importancia que tienen los parámetros fisicoquímicos de los tanques de reproductores en el éxito reproductivo (Encomendero et al., 2011). En otras especies del género se ha evaluado el efecto que presentan tanto los factores fisicoquímicos de cultivo, como las condiciones del mismo (aireación, densidad, tipo y coloración de tanque) en la supervivencia y el desarrollo efectivo de las crías de caballito de mar (Woods, 2003a; b; c; Otero et al., 2007; Quintas et al., 2007; 2010, Planas et al., 2009b; 2012; Segade-Botella, 2009; Blanco et al., 2010; 2011a; b; Cabrera, 2010; Martínez-Cárdenas, 2010; 2011; Olivotto et al., 2011; García et al., 2012; Amaral-Ruíz, 2013; Melo-Valencia et al., 2013; Blanco, 2014), así como en la frecuencia de apareamiento, calidad de huevos y en la maduración sexual de juveniles y adultos (Chamorro & Planas, 2007; Planas et al., 2008a; b; c; 2009a; 2010a; b; c; 2013; Álvarez et al., 2009; Planas & Quintas, 2009; Silveira & Ferreira, 2010; Flores-Zavala, 2011; Blanco, 2014; Saavedra et al., 2014). El mantenimiento, reproducción y crianza de Hippocampus ingens ha sido poco estudiado, mostrando elevadas tasas de mortalidad en el desarrollo temprano de los alevines (Reyes-Bustamante & Ortega-Salas, 1999; Encomendero et al., 20011; Ortega-Salas & Reyes-Bustamante, 2006), alcanzando incluso el 100% de mortalidad en los primeros 15 días de vida (Bisso-Bustamante, 2006). Es necesario aumentar el conocimiento sobre la crianza de H. ingens y desarrollar un protocolo que permita completar el ciclo del cultivo de la especie (Ortiz-Aguirre, 2018). Otro factor que se ha considerado primordial es la nutrición, por lo que se han evaluado cepas bacterianas aisladas de ejemplares silvestres como potenciales probióticos que permitan obtener una mayor supervivencia de los organismos en general en los sistemas de cultivo (Ortiz-Aguirre, 2018).
Origen: Los hipocampos son peces teleósteos de la clase Actinopterygii, su origen evolutivo se sugiere mediante divergencia a partir de un ancestro en común con los Scombrimorpharia hace aproximadamente 103 millones de años, dando origen a la familia Syngnathidae, donde se ubica el género Hippocampus Rafinesque, 1810 (Teske & Beheregaray, 2009; Lin et al., 2016). Los hipocampos actuales se originaron en la zona del Indo Pacífico antes del cierre del mar de Tetis, hace aproximadamente 20 millones de años, donde mediante procesos de dispersión y vicarianza se originaron las especies que conocemos hoy en día; con sus características morfológicas tan particulares, gracias a la acumulación de mutaciones favorables y a la adaptabilidad de los organismos del género (Casey et al., 2004; Lourie & Vincent, 2004; Lourie et al., 2005; Ortiz-Aguirre, 2018). En relación con las especies americanas, se piensa que Hippocampus ingens Girard, 1858 e Hippocampus reidi (Ginsburg, 1933), especies del Pacífico y Atlántico, respectivamente, divergieron de un ancestro común con la emersión del Istmo de Panamá, que data de entre 4.5 y 3.1 millones de años.
Estatus del cultivo: Cultivo experimental y comercial -la empresa Ingens Cultivos Marinos ubicada en Mazatlán, Sinaloa desarrolla el cultivo para venta, incluyendo exportación.
Mercado: Nacional e internacional.
Limitantes técnico-biológicas de la actividad: Abastecimiento de reproductores para un mejoramiento genético de las líneas de cultivo. Nutrición adecuada de reproductores, alevines y juveniles mantenidos en cultivo. Mayor control en las condiciones de cautividad.
II. ENTIDADES DE CULTIVO
Baja California Sur, Sinaloa.
III. ANTECEDENTES DE LA ACTIVIDAD
Hippocampus Ingens - también conocido como caballito de mar del Pacífico- pertenece a la especie de peces de la familia Syngnathidae en el orden de los Syngnathiformes, al igual que el resto de los caballitos de mar. Estos curiosos peces tienen demanda en el mercado como organismos de ornato para acuarios, así como souvenirs en diferentes partes del mundo. De igual forma, en diversas partes del mundo, incluyendo México, se llegan a emplear en la medicina tradicional, atribuyéndoseles diversas propiedades benéficas para la salud (Vincent, 1996; Lin et al., 2008; Chang et al., 2013; Chen et al., 2015), y se utilizan como alimento, ya sea por la creencia de ser un afrodisíaco o por innovación culinaria (Ortiz-Aguirre, 2018).
IV. INFORMACIÓN BIOLÓGICA
Distribución geográfica: Se extiende desde las costas de San Diego, California en Estados Unidos hasta el Perú, incluyendo el Golfo de California y las Islas Galápagos.
Morfología: La cabeza del caballito de mar tiene forma de caballo -de este peculiar parecido deriva su nombre-, con una pequeña corona -cresta ósea- en la parte superior de la cabeza. Su cuerpo y cola están cubiertos por una armadura de placas o anillos óseos concéntricos. Tienen una marcada diferenciación sexual, los machos presentan una "bolsa incubadora", con un orificio situado en la parte ventral del tronco. Carecen de aleta caudal. En su lugar tienen una cola prensil que se enrolla en espiral y les permite agarrarse a estructuras rígidas. Tienen un hocico largo y tubular, con un sistema muscular que le permite utilizarlo como succionador potente al momento de alimentarse, haciendo pasar el agua por las branquias, atrapando los organismos de su dieta, para luego introducirlo a su sistema digestivo. Las branquias son parte del aparato respiratorio con la función de extraer el oxígeno del agua y eliminar el dióxido de carbono. El resto de órganos internos son similares morfológica y fisiológicamente hablando al resto de peces: hígado (hepatopáncreas), riñón, vejiga urinaria, vejiga natatoria, corazón, y aparatos reproductores. Sus colores varían y van desde el color negro, gris, café, rojo, blanco y amarillo y se mimetizan con lo que los rodea, principalmente con las algas a las que adhieren sus cuerpos usando sus colas y que los ayuda a esconderse de sus depredadores. El caballito de Mar del Pacífico es generalmente amarillento cuando lo encontramos en las costas de San Diego, California, USA. El gran parecido morfológico entre muchas especies, el elevado número de nombres comunes que aparecen en la literatura (>120), la hibridación documentada en cautiverio y dado que los caracteres taxonómicos que se emplean para la discriminación de especies son ambiguos en muchas ocasiones no solo son características cualitativas, sino que suelen repetirse entre especies (número de discos en la sección caudal y parte dorsal del tronco, patrones de coloración, presencia de cirros, corona y/o tubérculos oculares, proporción de tamaño de boca respecto al cuerpo, así como el número de radios en aletas dorsal y anal), hacen que su taxonomía sea compleja y resulte complicada su identificación, es por ello que no se ha determinado un número consensual de especies, teniendo en la actualidad entre 33 a 71 especies según la base de datos o el grupo de trabajo que se consulte (Vincent, 1999; CITES, 2002a; Lourie et al., 2004; Lourie et al., 2016; Ortiz-Aguirre, 2018).
Ciclo de vida: Los patrones reproductivos se han evaluado a partir de organismos en cautiverio, sin embargo, investigaciones recientes sugieren que forman grupos familiares, formados por uno o dos machos y al menos tres hembras. No presentan temporadas de apareamiento pues se pueden reproducir a lo largo de todo el año, con la capacidad de liberar más de 1500 crías cada dos o tres semanas (cada macho), las que presentan una tasa de crecimiento de 0.7 cm por semana y alcanzan la madurez sexual a los cuatro meses, con una talla aproximada de seis centímetros (Reyes-Bustamante & Ortega-Salas, 1999; Ortega-Salas & Reyes-Bustamante, 2006; Encomendero et al., 2011; Ortiz-Aguirre, 2018). Es necesario incrementar el conocimiento, principalmente en ejemplares silvestres. Todas las especies de caballito de mar estudiadas en su medio ambiente natural parecen ser monógamos durante un ciclo de reproducción. Al formar la pareja, los machos solo aceptan los huevos de esta hembra, los vínculos de las parejas monógamas están reforzados comúnmente por contactos diarios que se convierten en una especie de cortejo una vez que el macho tiene el parto (Lourie et al., 2004). No obstante, se encontró algo distinto cuando se trata del cultivo de caballitos de mar: Después de estudiar a los organismos no se observa un comportamiento monógamo exclusivo como el descrito en el medio natural (Vincent y Sadler, 1995; Bull, 2002), un macho puede cruzarse con más de una hembra, incluso en un mismo evento reproductivo, lo que garantiza un mayor número de crías (Ospina-Salazar, G.H., et al., 2011).
Hábitat: Se ha documentado la presencia de Hippocampus ingens en costas del Pacífico Oriental, desde la zona submareal y hasta los 72 m de profundidad, en arrecifes rocosos y coralinos, praderas de fanerógamas marinas, mangles, mantos de macroalgas, estructuras artificiales como marinas y muelles, incluyendo zonas de sedimento blando como lodazales y zonas arenosas (Jones et al., 1988; Perante et al., 1996; Aranda-Mena, 2000; Rangel-Dávalos, 2000; Villareal-Cavazos et al., 2000; IFAW, 2002; Avendaño-Ibarra et al., 2004; Foster & Vincent, 2004; Lourie et al., 2004; Baum & Vincent, 2005; Quiñe & Romero, 2007; Ortiz-Aguirre, 2012), en ambientes de fondos blandos y duros (Lourie et al., 2004; Lourie et al., 2005; Quiñe & Romero, 2007), con una incidencia mayor en zonas arrecifales (Alvarez-León & Wedler, 1982; Campos & Gamboa, 1989; Villareal-Cavazos et al., 2000). En México el caballito de mar del Pacífico Hippocampus ingens tiene como zonas de distribución documentadas actualmente zonas de macroalgas en Isla Guadalupe y bahía Tortugas (Beccerril, et al, 2018; Ortiz-Aguirre, 2018), ambientes de macroalgas, arrecifes rocosos, de fondos blandos y zonas arenosas con cantos rodados en la bahía de La Paz (Ortiz-Aguirre, 2018), y en las praderas marinas de la Bahía de Mazatlán.
Alimentación en medio natural: La información que se tiene sobre su alimentación se ha generado con base en estudios realizados bajo condiciones controladas, lo que sostiene la hipótesis de que se alimentan principalmente de crustáceos, como misidáceos, eufáusidos, anfípodos y copépodos, así como de microorganismos como rotíferos, dependiendo la etapa de desarrollo (Reyes-Bustamante & Ortega-Salas, 1999; Baum & Vincent, 2005; Ortega-Salas & Reyes-Bustamante, 2006; Sandoval-Muy & Barón, 2007). Mediante análisis isótopico y por observación de contenido digestivo, se determinó que H. ingens es consumidor terciario alimentándose en la zona intermedia entre costa y mar adentro, teniendo como presas misidáceos y larvas de peces (Ortiz-Aguirre, 2018), considerándolos depredadores voraces, pues las tasas de alimentación son altas (observaciones en cautiverio). Sus ojos, que tienen movilidad independiente entre sí, les ayudan a reconocer sus presas, la cual, cuando se encuentra a su alcance es aspirada a través de su hocico por medio de un rápido movimiento muscular en la mandíbula. Tragan enteras a sus presas al no disponer de dientes, y se ven obligados a consumir grandes cantidades de comida para compensar su rápida e ineficiente digestión al no poseer estómago.
V. CULTIVO - ENGORDA
Biotecnología: Incompleta.
Sistemas de cultivo: Sistemas cerrados de recirculación de agua.
Características de la zona de cultivo: Aguas tropicales, templadas y poco profundas, alrededor de arrecifes, pastizales marinos y mangles.
Artes de cultivo: Condiciones controladas de laboratorio y de estanque.
Promedio de flujo de agua para el cultivo: Los recambios de agua dependen en gran medida de la carga biológica presente en el sistema, por lo que es importante mantener un monitoreo constante de la calidad del agua para lograr el cultivo a escala comercial. Recambios de agua del 10-20% cada dos o tres días resultan adecuados para mantener estables los parámetros hidrológicos.
Densidad de siembra: Las densidades de cultivo aún no se han estandarizado, Reyes-Bustamante & Ortega-Salas (1999) reportaron que de un total de 3,950 ejemplares sembrados en un estanque exterior de 100 m3, se cosecharon 3,332 ejemplares juveniles al final de la novena semana (mortalidad 16%), mientras que Ortiz-Aguirre et al. (2018), reportaron que de 17 nacimientos exitosos que obtuvieron, con un promedio de 565 alevines por cada alumbramiento, no se consiguió una supervivencia superior al 10% en ningún caso, logrando llevar ejemplares hasta los 95 días de cultivo.
Tamaño del organismo para siembra: Al nacer H. ingens mide 0.74 cm (Correa et al. 1989). Sin embargo, puede variar la longitud promedio de las larvas al nacer: entre 0.68 y 0.69 cm, por las condiciones de laboratorio.
Porcentaje de sobrevivencia: Variable del 10 al 84% (Reyes-Bustamante & Ortega-Salas, 1999; Ortiz-Aguirre et al., 2018).
Tiempo de cultivo: 9 semanas.
Tamaño promedio de cosecha: 1.4 cm al final de la primera semana.
VI. PIE DE CRÍA
Origen: Nacional.
Procedencia: Bahía de Mazatlán.
VII. ALIMENTO
A los reproductores obtenidos del medio natural se les alimentó con Artemia franciscana. Durante la primera semana de cultivo se alimentan con rotíferos.
Alimentación de H. ingens durante la primera semana de cultivo en el acuario.
| Días
| Microalgas
| Rotíferos
| Copépodos
| Artemia
|
| 1 | 1 1.5 X 106
| 10 - 20 / ml
| | |
| 2 | 2 1.5 X 106
| 10 - 20 / ml
| | |
| 3 | 3 1.5 X 106
| 10 - 20 / ml
| | |
| 4 | 4 1.5 X 106
| 10/ml
| 20 - 30 / ml
| |
| 5 | 5 1.5 X 106
| | 20 - 30 / ml
| |
| 6 | 6 1.5 X 106
| | 20 / ml
| 20 - 30 / ml
|
VIII. PARÁMETROS FÍSICO-QUÍMICOS
| PARÁMETRO
| INTERVALO
|
| Temperatura (°C)
| 23.3 - 29.0
|
| pH
| 8.5 - 9.1
|
| Salinidad (ups)
| 36 - 38
|
| Oxígeno (mg/L)
| 3.6 - 8.7
|
| Turbidez (cm)
| 35 - 50
|
Se considera que temperaturas por debajo de 26°C son recomendables, además de un fotoperiodo de 12:12.
IX. SANIDAD Y MANEJO
Importancia de la sanidad acuícola: Al igual que muchas especies de peces en cultivo, los caballitos de mar son susceptibles a enfermedades, principalmente si se les mantiene en grandes densidades o en condiciones de cultivo sub-óptimas, lo cual los hace más vulnerables.
Enfermedades reportadas: La enfermedad de la burbuja de aire es una de las principales causas de mortalidad en todos los estadios de vida de los caballitos de mar, aunque generalmente las crías son más propensas a padecer de esta enfermedad cuando los sistemas no son efectivos. (Woods, 2000).
Buenas prácticas de producción acuícola: Es necesario realizar rutinas de mantenimiento y limpieza de los sistemas de cultivo de las crías, juveniles y pre-adultos en las cuales deben observarse ciertos cuidados particulares.
X. MERCADO
Presentación del producto: Vivo para acuarios y disecado para uso medicinal o artesanía.
Precios del producto: Un ejemplar en el mercado mexicano puede llegar a costar más de $800 MXN, según tamaño color o características, se venden vivos como ornato en las ciudades de Mazatlán y Ciudad de México, y disecados en tiendas de artesanos de destinos turísticos cercanos a las playas donde habitan (CITES, 2002; Sanders et al., 2008).
Comercio Internacional: A nivel internacional del 2009-2019 se han comerciado un promedio de 1262 ejemplares criados en cautiverio por año (trade.cites.org). El principal propósito del comercio fue económico (99%). Los principales países que exportaron los ejemplares fueron México (99%) y Países Bajos (1%) (trade.cites.org), como especies de ornato por individuo puede oscilar alrededor de los $2,598.50 pesos por individuo en el mercado internacional.
XI. INFORMACIÓN Y TRÁMITES
Para el cultivo de esta especie se debe realizar el registro correspondiente como Unidad de Manejo para la Conservación de Vida Silvestre ante la SEMARNAT.
I. SEMARNAT: www.gob.mx/semarnat
II. CONAPESCA: www.gob.mx/conapesca
III. SENASICA: www.gob.mx/senasica
IV. COFEPRIS: www.gob.mx/cofepris
V. CONAGUA: www.gob.mx/conagua
XII. NORMATIVIDAD
Además de considerar anexo normatividad general, revisar la siguiente normativa específica para la especie y considerar que se encuentra en la categoría de riesgo como especie sujeta a protección especial (Pr).
Norma Oficial Mexicana NOM-059-SEMARNAT-2010, Protección ambiental-Especies nativas de México de flora y fauna silvestres-Categorías de riesgo y especificaciones para su inclusión, exclusión o cambio-Lista de especies en riesgo.
La especie se encuentra listada en el Apéndice II de la CITES, por lo cual su comercio internacional se permite, pero se regula. Si se pretende exportar se requiere cumplir con la definición de cría en cautiverio de la Resolución 10.16 (Rev.) de la CITES, que en términos generales implica la reproducción en ciclo cerrado hasta obtener especímenes de segunda generación.
XIII. MANEJO ECOSISTÉMICO
El declive en los reportes pesqueros durante la década de 1990, la degradación del hábitat por efecto antropogénico y evaluaciones de poblaciones silvestres de caballito de mar en diversas localidades a nivel mundial (Vincent, 1996; Baum & Vincent, 2005; Grey et al., 2005; Koldewey et al., 2005; Quiñe & Romero, 2007; Sanders et al., 2008), sustentan la hipótesis de la pérdida de los hipocampos en el medio, lo anterior, aunado al desconocimiento que se tiene sobre todas las especies de caballito de mar, ha incentivado la protección del género por parte de gobiernos y asociaciones como la Unión Internacional para la Conservación de la Naturaleza UICN (CITES, 2002a; 2002b; 2005; DOF; 2002; DOF, 2010a, 2010b; DOF, 2014b; Rosa et al., 2005; Lawson et al., 2015). La Convención sobre el Comercio Internacional de Especies Amenazadas de Fauna y Flora Silvestres (CITES) han brindado protección al género completo, incluyendo a todas las especies de caballitos de mar en el apéndice dos de la lista roja del CITES. De manera específica para H. ingens, el CITES la cataloga como vulnerable y con carencia de datos para las poblaciones silvestres. En México se encuentra dentro de la NOM-059-SEMARNAT-2000, bajo protección especial, categoría otorgada únicamente con base en criterios de intervalo de distribución y estado del hábitat (IFAW, 2002; SEMARNAT, 2002; IFAW, 2004; CITES, 2005; IUCN, 2006; Ortiz-Aguirre, 2018).
XIV. INVESTIGACIÓN Y BIOTECNOLOGÍA
El cultivo experimental del caballito marino se puede proyectar a escala comercial (Téllez et al. 1997). Por lo que es necesario desarrollar técnicas para el manejo integral del cultivo en condiciones controladas de laboratorio y de estanquería. Se realiza investigación en colaboración de la Universidad Autónoma de Baja California Sur y el Centro Interdisciplinario de Ciencias Marinas en La Paz, para mejorar los protocolos de cultivo y lograr un ciclo cerrado con tasas altas de supervivencia, incluyendo estudios de la microbiota asociada tanto a los hipocampos como a los sistemas de cultivo de apoyo, así como la evaluación de distintas fuentes de alimento y el efecto del enriquecimiento de las mismas (Ortiz-Aguirre, 2018; Ortiz-Aguirre et al., 2018).
Especialistas de la Unidad Académica Sisal de la Universidad Nacional Autónoma de México (UNAM), lograron desarrollar con éxito un paquete tecnológico para la crianza y reproducción de caballitos de mar o hipocampos con fines de comercialización; Se elaboran manuales de cultivo para todas las especies que opera la Unidad Sisal.
Sanidad: Para mantener en buen estado de salud a estas especies, al igual que al resto de organismos acuáticos para crianza, se debe atender a los parámetros físicos y químicos establecidos en las investigaciones de cultivo en condiciones controladas, además de realizar buenas prácticas de producción acuícola.
Comercialización: La mayoría de especies de caballitos de mar (Hippocampus spp.) son apreciados para su utilización en medicina tradicional, curiosidades y en la acuarofilia. Se tiene un mejor registro del comercio de caballitos de mar vivos (principalmente para acuarios), que del comercio de caballito de mar seco (para la medicina tradicional china), este último proveniente casi en su totalidad del medio silvestre e involucra los mayores volúmenes (Foster et al., 2014). Se ha estimado que de 2004 a 2008 se comercializó un promedio de 10 millones de caballitos de mar secos y 120 mil vivos por año (Vincent et al. 2011).
Tecnología de alimentos: Son escasos los estudios hace falta información al respecto.
XV. EFECTOS AMBIENTALES Y CAMBIO CLIMÁTICO
No se tiene documentado de forma específica del impacto en las poblaciones de caballitos de mar, sin embargo y siendo Hippocampus ingens categorizada como especie vulnerable (VU) con una tendencia poblacional en decremento -al igual que H. erectus-, en la Lista Roja de la Unión Internacional para la Conservación de la Naturaleza (UICN 2015) están siendo afectadas por la degradación de los ambientes costeros que habitan (Vite-García et al., 2017).
XVI. ESTADÍSTICAS DE PRODUCCIÓN
No se disponen cifras oficiales.
5.4 Corales
I. GENERALIDADES
Nombre(s) común(es) y nombre(s) científico(s): Las principales especies cultivadas en México se describen en el cuadro adjunto.
| Nombre común
| Nombre científico
| Categoría de riesgo (De
acuerdo con la NOM-059-
SEMARNAT-2010)
|
| Coral cuerno de alce | Acropora palmata (Lamarck, 1816), | Sujeta a protección especial (Pr) |
| Coral cuerno de ciervo o cuerno de venado | Acropora cervicornis (Lamarck, 1816) | Sujeta a protección especial (Pr) |
| Coral verdadero | Acropora prolifera (Lamarck, 1816) | |
| Coral dedo | Porites porites (Pallas, 1766) | |
| Coral lechuga | Agaricia tenuifolia (Dana, 1848) | |
| Coral lechuga | Agaricia agaricites (Linneaus, 1758) | |
| Coral estrella | Orbicella annularis (Ellis & Solander, 1786) | Amenazada (A) |
| Coral estrella | Orbicella faveolata (Ellis & Solander, 1786) | Amenazada (A) |
| Coral piña | Dichocoenia stokesii Milne Edwards & Haime, 1848 | |
| Gran coral estrella | Montastraea cavernosa (Linnaeus, 1767) | |
| Coral cerebro | Pseudodiploria clivosa (Ellis & Solander, 1786) | |
| Coral cerebro | Pseudodiploria strigosa (Dana, 1846) | |
| Coral estrella masiva | Siderastrea siderea (Ellis & Solander, 1786) | |
| Coral estrella masiva | Siderastrea radians (Pallas, 1766) | |
| Coral pilar | Dendrogyra cylindrus (Ehrenberg, 1834) | |
| Coral cerebro mayor | Colpophyllia natans (Houttuyn, 1772) | |
Nivel de dominio de la biotecnología: Producción de colonias por propagación clonal mediante técnica de fragmentación y microfragmentación; así como reclutas sexuales mediante fertilización asistida, a partir de la colecta de gametos de colonias silvestres.
Origen: Mar Caribe y Golfo de México.
Estatus del cultivo: Escalamiento de la producción y mejoramiento de técnicas de cultivo.
Mercado: Nacional e internacional.
Limitantes técnico-biológicas de la actividad: Reproducción sexual anual con baja sobrevivencia de reclutas en la mayoría de las especies. Tecnología y conocimiento limitados para mejoramiento genético.
II. ENTIDADES DE CULTIVO
Quintana Roo, Veracruz.
III. ANTECEDENTES DE LA ACTIVIDAD
En México el cultivo de corales para acciones de restauración de arrecifes es incipiente. Los primeros intentos se llevaron a cabo mediante la instalación de viveros marinos para rescate de corales fragmentados por encallamientos y huracanes en los años 2004 y 2005 en el Caribe mexicano. En el 2009 se establece el primer sistema de cultivo controlado para cultivo de corales con base en tierra. Posteriormente (2012-2016) se desarrollan técnicas para la producción de corales por propagación clonal, con una producción anual de 8,000 colonias de 8 especies (A. palmata, A. cervicornis, O. annularis, O. faveolata, M. cavernosa, U. agaricites, P. porites, D. cylindurs), y por reproducción sexual asistida logrando el asentamiento de reclutas sexuales de 2 especies (A. palmata y O. faveolata). Actualmente se producen colonias de coral mediante propagación clonal de 8 especies más (A. prolifera, C. natans, P. clivosa, P. strigosa, D. stokesii, U. tenuifolia, S. siderea y S. radians), y se trabaja en el desarrollo de técnicas de cultivo innovadoras como la microfragmentación y fusión de tejido, en el mejoramiento de procesos de cultivo para escalar la producción, y se inician las pruebas de dispersión asistida en campo y de criopreservación de gametos de algunas especies.
IV. INFORMACIÓN BIOLÓGICA
Distribución geográfica: Arrecifes coralinos del Mar Caribe y Golfo de México.
Morfología: Variada, dependiendo de la especie. Principalmente colonias ramificadas o masivas.
Ciclo de vida: Organismos sésiles, solo algunas especies dioicas, que liberan sus gametos al medio acuático para una fecundación externa en la mayoría de las especies (difusores) y para una fecundación interna en algunas (criadores), para formar una larva plánula que después de un proceso de metamorfosis produce el pólipo primario, el cual por reproducción asexual se multiplica para formar una colonia de coral. En muchas especies, la propagación clonal de fragmentos de una colonia por factores ambientales es una estrategia de colonización y dispersión de biomasa muy eficiente.
Hábitat: Arrecifes de coral, desde 0-30 m de profundidad.
Alimentación en medio natural: Los pólipos de coral se alimentan del plancton que atrapan con sus tentáculos; además, estos corales establecen una relación simbiótica con algas unicelulares llamadas zooxantelas, las cuales proporcionan energía al coral, a través de su proceso fotosintético, para ayudar al proceso de calcificación del esqueleto del coral.
V. CULTIVO - ENGORDA
Biotecnología: Producción de corales por propagación clonal y producción de reclutas por reproducción sexual asistida.
Sistemas de cultivo: Extensivo para corales en viveros marinos. Semintensivo para corales producidos por propagación clonal, e Intensivo para reclutas sexuales del primer estadio.
Características de la zona de cultivo: Para los viveros marinos: Arenales poco profundos (2-5m) y zonas de laja cercanas a la Rompiente arrecifal.
Artes de cultivo: Sistemas de cultivo marinos (SCM): Estructura de PVC con conectores para fijar colonias de coral, instalados en el mar para crecimiento de los corales; diseños variables. Sistema de cultivo controlado (SCC): Estanques de 4.00 x 1.00 x 0.35 m, con volumen de 1,400 litros, flujo cerrado, filtración y esterilización de agua, luz artificial, y control de temperatura, para mantenimiento de reclutas sexuales, área de aclimatación, cuarentena y recuperación. Sistema de cultivo exterior (SCE): Estanques de cultivo semicontrolados (tanques medianos de 1.60 x 1 x 0.40 m con volumen de 640 litros con capacidad para 1,800 microfragmentos o 400 fragmentos; tanques grandes de 4 x 1 x 0.35 m, con volumen de 1,400 litros con capacidad para 4,500 microfragmentos o 800 fragmentos) con flujo abierto de 2 l/h de agua filtrada hasta 1 µm, control de temperatura y luz natural, para cultivo de corales en tierra.
Promedio de flujo de agua para el cultivo: Flujo principal (Q) 2 l/h para reposición por pérdida de evaporación.
Densidad de siembra: variable según la técnica de producción y la especie.
Tamaño del organismo para siembra: variable según la técnica de producción y la especie.
Porcentaje de sobrevivencia: 85% en promedio en los SCE, y 95% en los SCM.
Tiempo de cultivo: De 4 a 8 meses según la especie.
Tamaño promedio de cosecha: Fragmentos de 4 a 8 cm de longitud para especies ramificadas. Microfragmentos de 2.25 cm2 para especies masivas.
VI. PIE DE CRÍA
Origen: Colonias de coral del medio natural, aprovechando los fragmentos de oportunidad para la propagación clonal, y la colecta de gametos para la reproducción sexual asistida.
Procedencia: Arrecifes de la región.
VII. ALIMENTO
La mayoría de los cultivos se pueden mantener de manera adecuada sin adición de alimento. Sin embargo, en los sistemas de cultivo en tierra (SCC y SCE) se puede suministrar alimento vivo a base de rotíferos y nauplio de Artemia, así como suplementos químicos que se utilizan de manera comercial en la industria de la acuarofilia.
VIII. PARÁMETROS FÍSICO-QUÍMICOS
| Parámetro | Intervalo |
| Calcio | 380-450 ppm |
| Alcalinidad | 2.5-4 meq/L 7-11 dKH 125-200 ppm CaCO3 equivalentes |
| Salinidad | 35 ppt |
| Temperatura | 26-28° C |
| pH | 7.8-8.5 aceptable 8.1-8.3 óptima |
| Magnesio | 1250-1350 ppm |
| Fosfato | < 0.03 ppm |
| Amonio | <0.1 ppm |
| Silicio | < 2 ppm |
| Iodo | No se recomienda su control |
| Nitrato | < 0.2 ppm |
| Nitrito | < 0.2 ppm |
| Estroncio | 5-15 ppm |
IX. SANIDAD Y MANEJO
Importancia de la sanidad acuícola: Dado que la producción de corales, tanto por propagación clonal como por reproducción sexual asistida, requiere de la colecta del medio silvestre es necesario prevenir la introducción de agentes contaminantes y/o enfermedades del mar hacia los sistemas de cultivos.
Enfermedades reportadas: Blanqueamiento, enfermedad de la banda blanca, banda negra, banda amarilla, plaga blanca y recientemente el denominado "síndrome blanco".
Buenas prácticas de producción acuícola: La colecta de tejido del medio silvestre requiere de una cuarentena, previo a la producción de corales, que inicia con una limpieza del esqueleto, seguida de un tratamiento antiséptico con iodo en agua marina filtrada. Los corales en cultivo requieren de un manejo y revisión cotidianos, para evitar el crecimiento de algas y otros organismos como ciliados y poliquetos, y en caso necesario se aplican tratamientos para erradicarlos. En el manejo de los gametos para la reproducción sexual asistida se requiere la esterilización del agua y de todos los materiales utilizados. En los viveros marinos se necesita llevar a cabo un programa de limpieza para eliminar el exceso de algas y organismos competidores.
X. MERCADO
Presentación del producto: El coral se ubica dentro de las especies marinas ornamentales más buscadas en ese mercado.
Precios del producto: Varía dependiendo de la especie y el lugar, superando en ocasiones los $1400.00 MXN por unidad.
Mercado del producto: Programas de restauración de arrecifes y áreas dañadas por impactos humanos y naturales. Instalación de viveros como áreas demostrativas para turismo ecológico. Habilitación de hábitats artificiales marinos.
De las 16 especies nativas a México (listadas en el cuadro), en el periodo de 2009 a 2019, no hubo registros de comercio legal internacional de ejemplares criados en cautiverio originado en nuestro país (trade.cites.org) Solamente se encontró registro de comercio de ejemplares criados en cautiverio de las especies Undaria agaricites (syn. Agaricia agaricites) y Pseudodiploria strigosa (syn. Diploria strigosa), con un promedio de 439 kg/año y 10 especímenes/año respectivamente (trade.cites.org). En el caso de U. agaricites, el único propósito fue el económico, teniendo como único exportador a Haití; mientras que para P. strigosa, el único propósito fue científico, teniendo como único exportador a Barbados (trade.cites.org).
XI. INFORMACIÓN Y TRÁMITES
I. SEMARNAT: www.gob.mx/semarnat
II. CONAPESCA: www.gob.mx/conapesca
III. SCT: www.gob.mx/sct
IV. SEMAR: https://www.gob.mx/semar
XII. NORMATIVIDAD
Además de considerar anexo normatividad general, revisar la siguiente normativa específica para las especies:
Norma Oficial Mexicana NOM-059-SEMARNAT-2010, Protección ambiental-Especies nativas de México de flora y fauna silvestres-Categorías de riesgo y especificaciones para su inclusión, exclusión o cambio-Lista de especies en riesgo.
Ley de Vertimientos en las Zonas Marinas Mexicanas.
XIII. MANEJO ECOSISTÉMICO
La producción de corales permite diseñar e implementar acciones de restauración y rehabilitación de arrecifes coralinos con la intención de recuperar o mejorar las funciones ecosistémicas que brindan estos ambientes en las que se sustentan actividades económicas de alta relevancia como son la pesca y el turismo.
XIV. INVESTIGACIÓN Y BIOTECNOLOGÍA
Desarrollo tecnológico:
I. Generar las capacidades técnicas y logísticas para la investigación en el desarrollo de biotecnología para la producción de corales y la restauración integral de arrecifes coralinos.
II. Establecer centros de producción de coral que puedan sustentar las acciones de restauración activa de arrecifes coralinos en México.
III. Conformar bancos de genotipos exitosos, identificando los más resistentes a condiciones adversas como son la contaminación, enfermedades y los efectos del cambio climático.
IV. Desarrollar un plan de restauración de arrecifes coralinos a nivel nacional, con el objetivo de recuperar la estructura y función de estos ecosistemas.
Sanidad:
I. Desarrollar e implementar los protocolos de inocuidad y sanidad para el manejo de tejido vivo y gametos de coral para la producción de colonias, manejo de colonias en estanques y viveros marinos; así como durante la siembra de corales en el mar.
II. Identificar los agentes patógenos que causan enfermedades en los corales, y desarrollar los procedimientos de atención a enfermedades.
Comercialización: Valoración económica de los costos de producción de corales y rentabilidad de las acciones de restauración; así como de los bienes y servicios que brinda un ecosistema de arrecife, y contribuir a la valoración económica de daños al arrecife para aspectos de compensación y multas.
Tecnología de alimentos: Identificar los requerimientos nutricionales específicos para las principales especies de corales en cultivo.
XV. EFECTOS AMBIENTALES Y CAMBIO CLIMÁTICO
Se requiere implementar un plan de resiliencia y adaptación al cambio climático que incluya una red de arrecifes funcionales y la preservación del genoma de corales mexicanos y su crio-preservación a través del SUBNARGENA - CICESE de SADER, garantizando este recurso para las generaciones presentes y futuras.
XVI. ESTADÍSTICAS DE PRODUCCIÓN
5.5 Totoaba
I. GENERALIDADES
Nombre común: Totoaba.
Nombre científico: Totoaba macdonaldi (Gilbert, 1890).
Nivel de dominio de la biotecnología: Completo.
Origen: Endémica del Golfo de California o Mar de Cortés.
Estatus del cultivo: Ciclo completo: Crianza en Laboratorio y engorda en corrales cilíndricos flotantes o esféricos sumergibles.
Mercado: Nacional.
Limitantes técnico-biológicas de la actividad: Sensibilidad a la descompresión.
II. ENTIDADES DE CULTIVO
Existen Unidades de Manejo para la Conservación de la Vida Silvestre (UMA) registradas en los estados de Baja California, Baja California Sur y Sonora.
III. ANTECEDENTES DE LA ACTIVIDAD
La acuacultura de totoaba empezó hace más de 20 años en un programa pionero creado por el Gobierno de México en la UABC en Ensenada, BC, por otro lado, los procedimientos y protocolos para la captura de reproductores, maduración, desove, cultivo larvario, y crecimiento de juveniles fueron desarrollados originalmente en la UABC (True et al. 2009, True 2012). Posteriormente otro programa en el Centro Reproductor de Especies Marinas del Estado de Sonora (CREMES) del Instituto de Acuacultura del Estado de Sonora (IAES) en Bahía Kino, Sonora. Hubo ensayos en estanques rústicos en Ensenada por parte de dos empresas privadas entre 2007 y 2010, pero reportaron que las temperaturas bajas de la región estancaron crecimiento, en la temporada de 2016-2017 en el CREMES se realizó una prueba en raceways obteniendo tasas de crecimiento de 4 gr/día, factor de conversión alimenticia (FCA) 1.2 y supervivencias por arriba del 85%; en el mismo periodo la empresa Frutos del Mar realizó un cultivo en jaulas flotantes en la Bahía de Altata, Sinaloa, alcanzando una talla de 3 kg en un año. En 2012 Earth Ocean Farms (EOF) sembró juveniles de totoaba, proveniente de la UABC, en corrales esféricos sumergibles en el Mar de Cortés en San Juan de la Costa, cerca de La Paz, BCS.
Actualmente existen siete UMA, que trabajan con esta especie y cumplen con objetivos importantes como: Reproducción, engorda, conservación, investigación, repoblación, aprovechamiento comercial y educación ambiental.
IV. INFORMACIÓN BIOLÓGICA
Distribución geográfica: Se encuentran en el Océano Pacifico oriental central: el Golfo de California. Originalmente, la totoaba se podría encontrar desde la desembocadura del río Colorado hasta Bahía Concepción, ocasionalmente hasta la Bahía de La Paz en la costa este del Golfo (Valenzuela-Quiñonez 2014) y posiblemente hasta San José del Cabo (Peet 2009), y hasta la boca del rio Fuerte en el este (Juárez et al. 2016). Por otro lado, se ha confirmado la presencia de totoabas juveniles (machorros), pre-adultas y adultas (mayores a 65 cm de longitud) en las siguientes localidades: Alto Golfo de California; Puerto Lobos, Sonora. Así mismo se extiende el rango de distribución a Mármol, Sinaloa a 30 km al NW de Mazatlán.
Morfología: Cuerpo alargado con hocico puntiagudo agudo, boca grande de forma oblicua, con mandíbula inferior sobresaliente y aleta caudal convexa. Los machos pueden llegar a alcanzar los 200 cm de longitud total y 135 kg de peso (Fish Base 2017, Chao 1995; Barrera-Guevara 1990), pueden alcanzar hasta 30 años de edad (Berdegué 1955).
Ciclo de vida: La maduración en vida silvestre varía entre 5 a 7 años para las hembras con longitudes a partir de los 100 cm, mientras que en los machos se da entre los 4 a 6 años y se ha reportado a partir de los 75.5cm, en el caso de cautiverio se han observado ejemplares F1 maduros desde los 3 años con tallas mayores a los 80 cm y un peso a partir de 15kg, destacando un crecimiento más lento por temperaturas más frías al norte del Golfo de California.
Hábitat: Es un pez de clima subtropical (32°N-17°N) y bentopelágico.
Alimentación en medio natural: Se alimenta de peces, principalmente sardina y anchoveta, así como también de crustáceos bentónicos como camarones y cangrejos (Cisneros-Mata et al. 1995).
V. CULTIVO - ENGORDA
Biotecnología: Ciclo cerrado/completo. Existe un manejo de temperatura y fotoperiodo en sistema de recirculación, se producen los desoves naturales en la noche, Una vez fertilizados los huevos flotan y son colectados con skimmers, se siembran en tanques donde normalmente eclosionan en 24-horas a 23 °C. Las larvas se siembran en tanques de larvicultura, se alimentan con alimento vivo (rotíferos y artemia) y finamente se hacen destete con alimento balanceado. Se siembran en corrales sumergibles entre 10-15 gramos, 90-dias después del desove. El ciclo de cultivo dura entre 1 a 3 años, y los alevines alcanzan hasta 3 kg en su primer año de cultivo.
Sistemas de cultivo: Semi-intensivos a intensivos.
Características de la zona de cultivo: Aguas costeras protegidas, con ligeras corrientes y profundidades mayores a 5 metros dependiendo del arte de cultivo.
Artes de cultivo: Corrales esféricos sumergibles desde 273 m3, en la actualidad se manejan entre los 1,500-4,700 m3 de volumen, malla 1 1/5-pulgada, trabajan en la columna entre superficie y hasta 25 metros de profundidad, corrales flotantes de 12 metros de diámetro o más con caída de 5 metros o más, malla sardinera de ¼" y 2". IAES reporta (2018) experiencias de cultivo en estanquería tipo raceway con suministro de agua marina de pozo y de bahía.
Promedio de flujo de agua para el cultivo: 0.25-0.50 m/s.
Densidad de siembra: 0.50 kg/m3 en siembra, 10 kg/m3 en cosecha.
Tamaño del organismo para siembra: 10-15 gramos.
Porcentaje de sobrevivencia: 85-95 %.
Tiempo de cultivo: 12-30 meses.
Tamaño promedio de cosecha: 3-7 kg.
VI. PIE DE CRÍA
Origen: Organismos silvestres, segunda generación (F1), y tercera generación (F2).
Procedencia: Medio ambiente o laboratorio de cultivo/reproducción.
VII. ALIMENTO
Reproductores comen alimento natural y alimento balanceado (pellet), organismos de cultivo comen únicamente alimento balanceado (pellet).
VIII. PARÁMETROS FÍSICO-QUÍMICOS
Aunque el medio ambiente en donde radica la totoaba está caracterizado por aguas con bastante producción primaria, el cultivo se hace en aguas oceánicas limpias, oxígeno arriba de 7.0 mg/L y en temperaturas entre 20-30 °C.
IX. SANIDAD Y MANEJO
Importancia de la sanidad acuícola: Monitoreo constante del agua y del fondo marino para prevenir un impacto potencial por contaminantes y florecimiento de algas nocivas. Los corrales tienen protección contra depredadores, como lobos marinos y tiburones.
Enfermedades reportadas: Se ha detectado Vibrio spp. en algunos ejemplares después de manejo excesivo. Deterioro de la calidad del agua puede provocar la afectación del parásito Brooklynella hostilis, un protozoario ciliado.
Buenas prácticas de producción acuícola: Lineamientos para cultivo de peces marinos.
X. MERCADO
Presentación del producto: La presentación del producto es entero sin víscera fresco (-4 ºC), o bien filete fresco o congelado -18 ºC.
Precios del producto: ND.
Mercado del producto: Mercado nacional.
XI. INFORMACIÓN Y TRÁMITES
Para el cultivo de esta especie se debe realizar el registro correspondiente como Unidad de Manejo para la Conservación de la Vida Silvestre ante la SEMARNAT.
I. SEMARNAT: www.gob.mx/semarnat
II. CONAPESCA: www.gob.mx/conapesca
III. SENASICA: www.gob.mx/senasica
IV. CONAGUA: www.gob.mx/conagua
V. SEMAR: https://www.gob.mx/semar
XII. NORMATIVIDAD
Debido a que es una especie en peligro de extinción "P" (NOM-059-SEMARNAT-2010), además de considerar anexo normatividad general, revisar la siguiente normativa específica para la especie:
NOM-169-SEMARNAT-2018, Que establece las especificaciones de marcaje para los ejemplares, partes y derivados de Totoaba (Totoaba macdonaldi) provenientes de unidades de manejo para la conservación de vida silvestre.
Norma Oficial Mexicana NOM-059-SEMARNAT-2010, Protección ambiental-Especies nativas de México de flora y fauna silvestres-Categorías de riesgo y especificaciones para su inclusión, exclusión o cambio-Lista de especies en riesgo.
Listada en el Apéndice I de la Convención sobre el Comercio Internacional de Especies Amenazadas de Fauna y Flora Silvestres (CITES), lo cual significa que para su exportación se requiere registrar los criaderos de reproducción ante la Secretaría de la CITES con base en los lineamientos de la Resolución 12.10 (Rev. CoP15) (que demuestra la operación legal del criadero) y cumplir con la definición de cría en cautiverio.
XIII. MANEJO ECOSISTÉMICO
Liberación de alevines o "machorros" (20-30 cm de largo y pesos de 0.5 a 2 gr o mayores) para repoblamiento a partir de parentales silvestres o de individuos reproductores F1.
XIV. INVESTIGACIÓN Y BIOTECNOLOGÍA
Desarrollo tecnológico: Impulsar la engorda por medio de técnicas de maricultivos en corrales/jaulas en el mar.
Sanidad: Continuar con el monitoreo de la calidad del agua donde se ubican los corrales, identificar posibles parásitos y definir su patogenicidad.
Comercialización: Buscar y expandir a mediano plazo, mercados alternos (asiáticos y europeos) para el producto, con el fin de incrementar el crecimiento de este sector o del valor de su producto, sin embargo, al ser una especie listada en el Apéndice I de la CITES y cuyas poblaciones silvestres podrían verse afectadas por el comercio internacional, no se permitirá su exportación con fines comerciales a menos que se cumplan ciertos criterios. Estos criterios se describen en la resolución Conf. 12.10 (Rev. CoP15) sobre el Registro de establecimientos que crían en cautividad especies de fauna incluidas en el Apéndice I con fines comerciales. Cabe destacar que el criadero debe poder comprobar que los especímenes producidos han sido efectivamente "criados en cautividad", según las condiciones enunciadas en la Resolución Conf. 10.16 (Rev.) sobre Especímenes de especies animales criados en cautividad.
Tecnología de alimentos: Desarrollo a nivel nacional de alimento de calidad comercial para esta especie.
XV. EFECTOS AMBIENTALES Y CAMBIO CLIMÁTICO
Fenómenos naturales en las zonas de cultivo afectan directamente la actividad ya que son un riesgo para la infraestructura y la biomasa existente en las granjas de cultivo. El incremento de la temperatura del mar también puede ocasionar problemas por la producción de microalgas en excesos (Bloom de algas, mareas rojas) afectando la salud de los peces.
XVI. ESTADÍSTICAS DE PRODUCCIÓN
Se encuentran siete UMA registradas en la actualidad:
I. Unidad de Biotecnología en Piscicultura de la UABC, Ensenada, Baja California;
II. Centro Reproductor de Especies Marinas del Estado de Sonora (CREMES), en Hermosillo, Sonora;
III. Earth Ocean Farms, S. de R.L. de C.V., en La Paz, Baja California Sur;
IV. Pacifico Acuaculture S. de R.L. de C.V., en Ensenada, Baja California;
V. DENEB (CYGNUS OCEAN FARMS, S.A. DE C.V.), en Guaymas, Sonora;
VI. Acuario Oceánico (ACUARIO OCEÁNICO, S. DE R.L. DE C.V.) en San Felipe, Mexicali, Baja California;
VII. Desarrollo del Alto Golfo de California, San Luis Río Colorado, Sonora.
5.6 Trucha nelsoni
I. GENERALIDADES
Nombre común: Trucha nelsoni, trucha de San Pedro Mártir.
Nombre Científico: Oncorhynchus mykiss nelsoni (Evermann, 1908).
Nivel de dominio de biotecnología: Experimental.
Origen: Sierra de San Pedro Mártir, Baja California.
Estatus de cultivo: Experimental.
Mercado: Local y regional.
Limitantes técnico-biológico de la actividad: Disponibilidad de biotecnología de cultivo a niveles productivos.
II. ENTIDADES DE CULTIVO
Baja California.
III. ANTECEDENTES DE LA ACTIVIDAD
La distribución restringida y baja abundancia de O. mykiss nelsoni en su hábitat natural, han permitido que esta subespecie esté sujeta a protección especial de acuerdo a la NOM-059-SEMARNAT-2010 (DOF 30/XII/2010). Esta trucha nativa y endémica de Baja California, representa un patrimonio biogeográfico y evolutivo que le confieren prioridad de conservación. Además de lo anterior, su relativa capacidad euritérmica y comportamiento no migratorio, le dan un alto potencial atractivo para la acuacultura, especialmente orientada a las necesidades del actual cambio climático. Los estudios sobre la reproducción ex situ de esta trucha se iniciaron desde hace dos décadas, lográndose la reproducción y desarrollo ontogénico de manera exitosa bajo condiciones de fotoperiodo y alimentación controlada, además de la obtención de esperma de calidad para su ingreso al banco de germoplasma del CICESE (Ruiz-Campos, 1994; Garduño-Franco, 1994; Aguilar-Juárez, 2010).
IV. INFORMACIÓN BIOLÓGICA
Distribución geográfica: Arroyos de la pendiente occidental de la Sierra de San Pedro Mártir, Baja California, desde altitudes de 500 a 2030 msnm (Ruiz-Campos y Pister, 1995).
Morfología: Presenta manchas negras en ambos lados del iris de los ojos. Aletas pareadas y color naranja brillante. Aleta pélvica de color amarillento y aleta anal presenta manchas negras de formas circulares y ovaladas de distinto tamaño. Línea lateral bien desarrollada, de color rojo o rosa. Presenta algunas manchas circulares negras en la región ventral (Ruiz-Campos et al., 2003). La diferenciación sexual entre individuos se basa en características sexuales secundarias a nivel de rostro y maxila. En las hembras el diámetro ocular es igual a la longitud del rostro y en machos este es mucho menor. En los machos, a partir del primer año se observa una protuberancia de color oscura en la parte apical de la maxila inferior y en las hembras el perfile es más redondeado (Ruiz-Campos, 1993).
Ciclo de vida: Se caracteriza por ser una especie de talla pequeña (< 220 mm LP), de lento crecimiento y poca longevidad ( 4 años) y fecundidad (15.3 ovos/cm LP). La primera madurez sexual la alcanza a los 103 - 111 mm LP y 1 año. La fecundidad tiene una relación directa con la talla, peso y edad de la trucha. La época de desoves ocurre en invierno (enero-marzo) con mayor intensidad en febrero. El reclutamiento de juveniles al stock, ocurre en primavera (mayo-junio) (Ruiz-Campos, 1993). El desarrollo ontogénico de esta subespecie, desde la fecundación hasta la absorción del saco vitelino, dura 37 días a temperaturas de 12.9 a 14.5 ºC (Ruiz-Campos, 1993; Garduño-Franco, 1994).
Hábitat: Arroyos de aguas frías, claras y bien oxigenadas. Muestra un patrón de permanencia en pozas y recodos con una profundidad >30 cm, mayor cobertura (sombreado), sustrato arenoso y mayor disponibilidad de presas (Ruiz-Campos y Pister, 1995).
Alimentación en el medio natural: Dieta insectívora, dominada en un 90% por cuatro tipos de presas (Simuliidae, Sericostomatidae, Hydropsychidae e Hydroptilidae), demostrando estrategias selectivas en el tipo y tamaño de presa consumida. La dieta cambia estacionalmente, siendo más evidente en invierno y primavera (Ruiz-Campos y Cota-Serrano, 1992).
V. CULTIVO - ENGORDA
Biotecnología: Experimental. El cultivo se ha realizado a nivel experimental bajo niveles de fotoperiodo y alimentación controlados.
Sistemas de cultivo: Intensivo.
Características de la zona de cultivo: Hasta el momento sólo se ha realizado el cultivo en sistemas de recirculación.
Artes de cultivo: Tanques circulares de fibra de vidrio (ver anexo "Artes de cultivo").
Promedio de flujo de agua para el cultivo: En cultivo experimental en sistema de recirculación se ha mantenido a 57 L/min.
Densidad y tamaño del organismo para siembra: ND.
Porcentaje de sobrevivencia en pruebas experimentales: En incubación el promedio fue del 65%. Sobrevivencia del alevinaje entre 76.3 y 99.4%. Trucha cultivada en primeros intentos fuera de sistema de recirculación, tuvo 96.6% de sobrevivencia (Garduño, 1994). En una investigación reciente se logró el 65% de sobrevivencia a los 13.2 meses de cultivo (Aguilar Juárez, 2010).
Tiempo de cultivo: Incubación: 21 a 23 días (13.7 a 14 ºC). Alevinaje: 14 a 21 días (12.9 a 14.5 ºC) (Garduño, 1994). En condiciones controladas se han mantenido hasta 14 meses (Aguilar Juárez, 2010).
Peso o talla de cosecha: Ejemplares mantenidos en cautiverio han logrado tallas de 350 mm de longitud total.
VI. PIE DE CRÍA
Origen: No existe un Centro Productor de alevines que brinde abasto para su cultivo comercial.
Procedencia: Organismos del ambiente natural.
VII. ALIMENTO
En uno de los primeros estudios se alimentaron inicialmente con larvas de coleópteros y lombrices de tierra, posteriormente se proporcionó gradualmente carne fresca e hígado, ambos molidos y finalmente alimento balanceado humedecido (Garduño, 1994). En cultivos experimentales recientes se ha utilizado alimento peletizado comercial para trucha arcoíris. Asimismo, en la etapa juvenil se han utilizado mísidos congelados a una razón equivalente del 3% de su peso húmedo, haciendo el reemplazo gradual con alimento comercial (42% proteína y 15% de lípidos, 3.5 mm diámetro), hasta que los organismos se acostumbren sólo al alimento comercial a una razón del 5% de su peso húmedo.
VIII. PARÁMETROS FÍSICO-QUÍMICOS
| PARÁMETRO
| PROMEDIO
| MÍN
| MÁX
|
| 1Nitrógeno Total de Amoniaco (mg/
L)
| 0.15 ± 0.09
| | |
| 1Nitritos (mg/L)
| 0.02 ± 0.09
| | |
| 1Nitratos (mg/L)
| 3.38 ± 7.71
| | |
| 1pH
| 7.93 ± 0.17
| 7.4
| 8.5
|
| 2Temperatura (ºC)
| | 16.5
| 24.5
|
1. Parámetros en sistema de recirculación.
2. Intervalo que tolera en el ambiente natural.
IX. SANIDAD Y MANEJO
Importancia de la sanidad acuícola: Reducir riesgos en los cultivos para disminuir la incidencia de enfermedades potenciales entre los organismos de la familia Salmonidae.
Enfermedades reportadas: ND.
Buenas prácticas de manejo acuícola: No existe un manual específico para esta variedad de trucha arcoíris. Sin embargo puede apegarse al Manual de Buenas Prácticas de Producción Acuícola de Trucha para la Inocuidad Alimentaria de SENASICA (https://www.gob.mx/cms/uploads/attachment/file/167793 /8_Manual_Trucha.pdf), aunque se recomienda tomar en cuenta los lineamientos para cualquier actividad acuícola. Algunos puntos importantes para las buenas prácticas de manejo son: a) mantener densidades de siembra adecuadas al estadio y talla de los peces, b) los organismos muertos o enfermos deberán ser desechados, c) todo el material utilizado durante el proceso de cultivo deberá ser desinfectado para evitar contaminación entre los diferentes organismos, d) llevar un control adecuado de la alimentación y el horario en el que este se suministre, y e) llevar a cabo monitoreo constante de la calidad del agua de cultivo.
X. MERCADO
Presentación del producto: Hasta el momento no se comercializa, pero se puede distribuir con la misma presentación que la trucha arcoíris O. mykiss.
Precios del producto: ND.
Talla promedio de presentación: ND.
Mercado del producto: Local y regional.
Puntos de ventas: ND.
XI. INFORMACIÓN Y TRÁMITES
I. SEMARNAT: www.gob.mx/semarnat
II. CONAPESCA: www.gob.mx/conapesca
III. SENASICA: www.gob.mx/senasica
IV. CONAGUA: www.gob.mx/conagua
XII. NORMATIVIDAD
Además de considerar anexo normatividad general, revisar la siguiente normativa específica para la especie:
Norma Oficial Mexicana NOM-059-SEMARNAT-2010, Protección ambiental-Especies nativas de México de flora y fauna silvestres-Categorías de riesgo y especificaciones para su inclusión, exclusión o cambio-Lista de especies en riesgo.
XIII. MANEJO ECOSISTÉMICO
En México la trucha nelsoni así como la trucha dorada (Oncorhynchus chrysogaster) se encuentran incluidas en la NOM-059 SEMARNAT-2010, como especie "sujeta a protección especial" (Pr), por lo que su regulación le compete a la SEMARNAT, a través de la Dirección General de Vida Silvestre, y su manejo y aprovechamiento sustentable sólo puede ser a través de Unidades de Manejo para la Conservación de la Vida Silvestre (UMA) y deberá sujetarse a lo dispuesto en la Ley General de Vida Silvestre y su Reglamento. Para el caso de Oncorhynchus mykiss nelsoni no se encuentra en la norma, pero se requieren trámites de Concesión ante SEMARNAT cuando se realice la actividad en continente y ante CONAPESCA cuando se realice el cultivo en jaulas en aguas de jurisdicción federal.
XIV. INVESTIGACIÓN Y BIOTECNOLOGÍA
La investigación científica y tecnológica, como herramienta fundamental, permite la definición e implementación de políticas, instrumentos, medidas, mecanismos y decisiones relativos a la conservación, restauración, protección y aprovechamiento sustentable de los recursos acuícolas; así como el establecimiento de programas que impulsen el desarrollo de la investigación científica y tecnológica para la diversificación productiva y el aprovechamiento de la acuacultura de especies nativas; por tal motivo se considera importante reforzar el estudio en:
Nutrición: Determinar requerimientos nutricionales y formular dietas comerciales específicas.
Genética: Se requiere evaluar la secuenciación genómica de esta subespecie.
Sanidad: Evaluar los efectos de agentes infecciosos en las diferentes etapas de cultivo.
Tecnología de cultivo: Definir eficiencia de las técnicas de cultivo y evaluar el costo de producción.
XV. EFECTOS AMBIENTALES Y CAMBIO CLIMÁTICO
No se tiene documentado de forma específica del impacto sobre las poblaciones de esta especie.
XVI. ESTADÍSTICAS DE PRODUCCIÓN
No se disponen cifras oficiales para el cultivo de esta especie.
6. VOCACIÓN Y POTENCIAL ACUÍCOLA
6.1 Sistema Lagunar de Alvarado
I. UBICACIÓN
El Sistema Lagunar de Alvarado se ubica en la Cuenca del Papaloapan en la Región Hidrológica 28, que tiene niveles de escurrimiento superficial de casi 1 000 mm y está limitada al oeste con la cuenca número 18 Río Balsas, al norte con la cuenca del río Atoyac del Estado de Veracruz (zona centro y norte), al este con la cuenca del río Coatzacoalcos y al sur con la cuenca de Tehuantepec del Estado de Oaxaca. Al Sistema Lagunar de Alvarado desembocan los ríos Papaloapan, Acula y Martín Prieto en la parte sureste, y los ríos Blanco y Camarón al suroeste. El complejo lagunar es somero, con una profundidad que oscila en sus partes más bajas entre 0.5 y 1.0 m, con la mayor Profundidad a lo largo del río Papaloapan con entre 9 m a 15 m en la boca de comunicación con el mar (Morán-Silva et al., 1996).
Población aledaña: El Sistema Lagunar de Alvarado, se localiza en la zona baja costera central del Estado de Veracruz, las subcuencas de los ríos Blanco, Camarón y Acula, que se interconectan en la parte más baja de la cuenca y en la estación de lluvias originan la formación de una llanura de inundación hídrica que, junto con el sistema lagunar de la zona, constituyen un gran vaso de almacenamiento. Esta zona tiene una extensión de aproximadamente 5,240 km2 y representa casi nueve por ciento de la superficie de la cuenca del Papaloapan. Las 44 localidades ubicadas en la ribera del cuerpo lagunar, se distribuyen en siete municipios del Estado de Veracruz los cuales son: Acula, Alvarado, Ignacio de la Llave, Ixmatlahuacan, Tierra Blanca, Tlacotalpan y Tlalixcoyan.
Actividades económicas (dentro del cuerpo de agua): Los humedales de Alvarado y municipios vecinos representan uno de los pilares productivos pesqueros más importantes de Veracruz y de México. El área también constituye uno de los principales centros de producción agrícola en Veracruz, incluyendo la agricultura de plantaciones, principalmente caña de azúcar; productos básicos como maíz y arroz; frutales tropicales como aguacate, mango, piña; y hortalizas como tomate, pepino, y sandía. Respecto a la flora y fauna de importancia económica, existen 142 registros de plantas útiles (42% medicinales, 33% alimenticias, 22% utilizadas como materiales de construcción y 4% con otros usos). La fauna útil también es económicamente importante e incluye al menos 3 especies de la malacofauna, 10 de los crustáceos y 20 de la ictiofauna, 7 especies de mamíferos, 7 de reptiles y 12 de aves (Portilla-Ochoa et al., 2002).
II. CARACTERÍSTICAS GEOFÍSICAS
Geomorfología: La zona corresponde a aluvión, por su estructura presenta zonas tanto permeables como impermeables, predominando las zonas arenosas a lo largo de antiguos cauces orientados de noroeste a sureste y que están labrados sobre sedimentos de las unidades arenosas y arcillo-arenosas. El aluvión forma acuíferos que se comporta en conjunto, como unidad de permeabilidad media. Las zonas permeables corresponden a zonas de cauce y las impermeables se señalan en los pantanos. Depresiones formadas por procesos no marinos durante el descenso del nivel del mar. Inundadas por la transgresión del Holoceno. Modificadas leve o fuertemente a partir de la estabilización del nivel del mar durante los últimos 5 mil años. La geomorfología es típicamente de un valle de río inundado; se presentan principalmente a lo largo de planicies costeras anchas y de bajo relieve; los cañones escarpados y rocosos se forman en relieves costeros altos; hay depresiones cársticas ovales e irregulares a lo largo de la costa.
Batimetría: El complejo lagunar es somero, con una profundidad que oscila en sus partes más bajas entre 0.5 y 1 m, con la mayor Profundidad a lo largo del río Papaloapan con entre 9 m a 15 m en la boca de comunicación con el mar (2 m promedio). Las zonas con mayor profundidad están a lo largo de la barrera arenosa, y en general la profundidad es modificada por deltas lagunares y formación de sub-lagunas.
Corrientes y Mareas: Está formado por dos corrientes: la primera nace en la Sierra Juárez, con el nombre de río Grande al que afluyen por la margen izquierda los ríos de Las Vueltas, Apoala, San Pedro y Tomellín, el cual forma el cañón de su nombre. La segunda corriente se origina en el Valle de Tehuacán, y recibe por la derecha a los ríos de Zapotitlán, Hondo y Jiquila; unidas las dos corrientes, atraviesa la Sierra Madre de Oaxaca por un estrecho cañón y se le conoce con el nombre de Quiotepec, recibe a su derecha al río Usila, 50 km al este afluye el río del Valle Nacional, tomando el nombre de Papaloapan. Se dirige al noroeste y recibe a la izquierda al río Tonto, se le une el río San Juan en el que descarga el lago de Catemaco, por medio del río Tuxtla formando el Salto de Eyipantla; desemboca finalmente en la Laguna de Alvarado, pasando antes por la Ciudad de Tlacotalpan (Benítez C. L., G. 2011). Las mareas muertas van de 0.24 a 0.26 m, las medias de 0.27 a 0.37 m y las vivas de 0.61 a 1.07 m.
Composición textural: El suelo es de tipo gleysol. Se caracteriza por la acumulación y estancamiento de agua en la época de lluvias. En la capa saturada con agua se observan colores azulosos, verdosos o grises que al secarse presentan manchas rojas, acumulación de sales y son poco susceptibles a la erosión. Los parámetros texturales reflejan las condiciones de depósito de los sedimentos y la influencia de los tres diferentes ambientes fluvial, lagunar y marino en el sistema lagunar. La concentración de metales en sedimentos superficiales fue baja en diciembre de 1980 y la concentración de zinc y cromo en sedimentos superficiales fue baja en diciembre de 1980 y la concentración de zinc y cromo aumentó en mayo de 1981, este aumento se atribuye a las descargas industriales procedentes del Río Blanco en esta época del año. Los parámetros sedimentológicos y químicos sugieren una velocidad de sedimentación constante y perfiles de concentración de metales homogéneos con la profundidad.
Aportes: El complejo lagunar de Alvarado forma parte de la región hidrológica de la cuenca del Papaloapan, su caudal ocupa el séptimo lugar mundial y junto con el Río Coatzacoalcos, representa el 30% del escurrimiento fluvial del país y es el segundo sistema fluvial más importante después del sistema Grijalva - Usumacinta. A la laguna de Alvarado descargan los escurrimientos provenientes de las subcuencas de los Ríos Blanco, Camarón y Acula. Estos ríos se interconectan en la parte más baja de la cuenca y, en la estación de lluvias, se forma una llanura de inundación hídrica que, junto con el sistema lagunario de la zona, constituyen un gran vaso de almacenamiento.
III. PARÁMETROS FÍSICO-QUÍMICOS
En el sistema lagunar, los parámetros físico-químicos están íntimamente relacionados con la temporada de lluvias, nortes y de estiaje, con el aporte fluvial de los ríos y escurrimientos provenientes de parte alta de la cuenca.
| PARÁMETRO | MÍN | MÁX | PROMEDIO |
| Temperatura (ºC) | **25.3 | *34.4 | 24.4 |
| En temporada de lluvia, se registra temperaturas menores a 31 °C, mientras que en tiempos de norte
mientras que en época de norte se alcanza los 34ªC.
|
| Salinidad (ups) | *2.0 | **14.3 | 8.8 |
| Los promedios más altos de salinidad se obtuvieron en la época de secas (14.3 ups) entre las lagunas de
Alvarado y Buen País, mientras que en la de lluvias (10 ups) en la Laguna Camaronera.
|
| Oxígeno (mg/L) | **3.5 | *8.2 | 5.6 |
| La concentración de oxígeno es estable a lo largo del año y se ve influenciado por las corrientes o el viento.
|
| Ph | **9.7 | **7.1 | 8.4 |
| Clorofila a (µg/L) | NR | NR | NR |
NOTA: * Época de Norte. **En época de lluvias
Impacto ambiental: El Sistema Lagunar de Alvarado enfrenta, la reducción y fragmentación del hábitat de la flora y de la fauna debido a la expansión de la frontera agropecuaria; reducción y deterioro del manglar ocasionado por actividades extractivas, la ganadería extensiva y otros cambios en el uso de suelo; reducción de especies de importancia económica para las pesquerías locales ocasionada por el incremento del esfuerzo pesquero, uso de artes de pesca prohibidas y cambios en la calidad de agua debido a diferentes tipos de contaminación; y problemas asociados al asolvamiento de los cuerpos de agua provocado por fenómenos erosivos en las partes altas por la eliminación de la cubierta forestal. Al igual que otros cuerpos lagunares del Estado de Veracruz que están fuertemente impactados, el Sistema Lagunar de Alvarado, ha resentido principalmente la influencia del Río Blanco y de los desechos industriales y caseros que acarrean sus aguas.
Contaminación: La contaminación de Sistema Lagunar, está relacionada directamente con:
I. Acarreos provenientes de la cuenca del Río Blanco;
II. Cambios de usos de suelo;
III. Desecho de industrias;
IV. Deforestación en la parte alta de la cuenca.
Presencia de coliformes en el sistema lagunar promedio anual
| Estación del año y Norma
| Coliformes totales NMP/100 g
| Coliformes fecales NMP/100 g
|
| Lluvias
| 240.0 - 30.0
| 180.0 - 14.0
|
| Nortes
| 210.0 - 14.0
| 165.0 - 10.0
|
Los nitritos, nitratos, fenoles y fosfato se encontraron en mayor concentración durante la época de lluvias en los sitios de muestreo de las lagunas de Alvarado, Camaronera y Tlalixcoyan, mientras que el nivel de amonio más alto se registró en época de secas en Tlalixcoyan. Los detergentes y sólidos totales fueron más altos en época de lluvia; los niveles de grasas y aceites fueron constantes en ambas épocas.
IV. LISTADO DE ESPECIES
| Especies nativas representativas del sistema lagunar
|
| Moluscos
| Ostión (Crassostrea virginica)
|
| Caracol (Melongena melongena)
|
| Almeja (Rangia cuneata, R. flexuosa, Polymesoda caroliniana)
|
| Crustáceos
| Jaiba (Callinectes rathbunae, C. sapidus)
|
| Langostino o camarón prieto (Macrobrachium acanthurus)
|
| Camarón (Litopenaeus setiferus; Farfantepeneus aztecus, y F. duorarum)
|
| Peces
| Lebrancha (Mugil curema)
|
| Lisa (Mugil cephalus)
|
| Robalo blanco (Centropomus undecimalis)
|
| Robalo prieto (Centropomus poeyi)
|
| Chucumite (Centropomus parallelus)
|
| Mojarra rayada (Eugerres plumieri)
|
| Castarrica (Cichlasoma urophthalmus)
|
| Mojarra guapota (Cichlasoma fenestratum)
|
| Mojarra pinta (Petenia splendida)
|
| | Sargo (Archosargus probatocephalus)
|
| Trucha (Cynoscion arenarius)
|
| Cintilla (Trichiurus lepturus)
|
| Ronco (Conodon nobilis)
|
| Bagre (Ariopsis felis)
|
| Bagre bandera (Bagre marinus)
|
| Naca (Dormitator maculatus)
|
| Guavina (Gobiomorus dormitor)
|
| Pez puerco (Ictiobus meridionalis)
|
Nota: Las especies son aprovechadas por la actividad pesquera.
V. ACTIVIDAD ACUÍCOLA EN EL SISTEMA LAGUNAR
| Especies que se cultivan
| Parámetros Físico-químicos para cultivo.
|
| Ostión
(Crassostrea virginica)
| Temperatura promedio: 27.8 °C
Oxígeno disuelto: 5 mg/L
pH: 7
Salinidad: 23.9 ups
|
| *Camarón blanco del pacífico
(Litopenaeus vannamei)
| Temperatura promedio: 28ºC.
Oxígeno disuelto: 6 mg/L
pH: 7 a 9
Salinidad: 25 ups
|
| Tilapias - mojarras (Oreochromis
niloticus)
| Temperatura: 24 a 30ºC
Oxígeno disuelto: 5 mg/L
pH: 7 - 8
|
NOTA: *Especie introducida y cultivada en la periferia del sistema lagunar.
I. Ostión: La actividad acuícola se desarrolla a través del regado de concha, para generar bancos artificiales, los cuales son manejados para realizar un aprovechamiento acuícola rústico.
II. Camarón: La engorda de camarón se hace en el perímetro del cuerpo lagunar, principalmente en la zona conocida como Laguna Camaronera. Se realiza comúnmente en estanques rústicos de 1.0 a 2.5 ha. Por otro lado, el cultivo se realiza, con la especie Litopenaeus vannamei, es una especie exótica para esta zona.
III. Tilapia nilótica: Actualmente el cultivo de tilapia ha sido a través de estanques. Sin embargo, esta especie es exótica y no se conoce la repercusión ecológica y sanitaria que pueda tener su presencia en el sistema lagunar.
| Especies con potencial de cultivo
| Parámetros Físico-químicos para cultivo.
|
| **Robalo (Centropomus poeyi)
Chucumite (Centropomus parallelus)
| Temperatura promedio: 27 a 30 ºC.
Oxígeno disuelto: 5 a 6 mg/L
pH: 7
Salinidad: 0 a 3 ups
|
| Ostión
(Crassostrea virginica)
| Temperatura promedio: 27.8 °C
Oxígeno disuelto: 5 mg/L
pH: 7
Salinidad: 23.9 ups
|
| **Castarrica (Cichlasoma urophthalmus)
| Temperatura promedio: 28 ºC.
Oxígeno disuelto: 7 mg/L
pH: 6.5 a 7
Salinidad: 0 a 35 ups
|
NOTA: **Especie nativa con potencial.
I. Ostión: El cultivo se ha realizado en la laguna y está probado que cuenta con las condiciones para el desarrollo de la especie, se propone como una de las especies con potencial de desarrollo en este cuerpo de agua, considerando los siguientes puntos: a) Especie nativa de este sistema lagunar, b) demanda regional y nacional, c) alto valor económico en la región, y d) actualmente se cuenta con tecnología para producirla en laboratorio.
II. Castarrica: El cultivo no se ha realizado en este sistema lagunar, sin embargo, se propone como una de las especies con potencial de desarrollo en este cuerpo de agua, considerando los siguientes puntos: a) Especie nativa de este sistema lagunar, b) adaptabilidad a amplios intervalos de salinidad, c) alto valor económico en la región, y d) actualmente se cuenta con tecnología para producirla en laboratorio. La engorda de esta especie se realiza principalmente a escala rural y experimental en la región de distribución natural de la misma, generalmente en estanquería rústica, sin embargo, podrían iniciarse cultivos de fomento en jaulas dentro del sistema lagunar, en las zonas más profundas de la laguna.
III. Robalo: Especies con potencial de cultivo (engorda) dentro del sistema lagunar, dado a que es nativa de la zona y se reporta como una pesquería en la misma. Sin embargo, esta posibilidad a la fecha, sólo podría darse como fomento, dado a que en la actualidad aún no se cuenta con cría producida en laboratorios. Para el caso de C. parallelus y C. undecimalis se conoce la tecnología, para su cultivo, reproducción y desarrollo larval desarrollado en instituciones de la región, en el caso de C. poeyi se han estudiado aspectos biológicos básicos para el desarrollo de su cultivo y se ha identificado una mejor tasa de conversión y crecimiento que en las otras dos especies. Sin embargo, las investigaciones en este tema, están siendo validadas actualmente para su posible transferencia al sector productivo.
VI. SANIDAD
Sanidad acuícola: En el sistema lagunar se ha reportado la presencia de: Cóccidios, Tremátodos (Bucephalus spp.), Céstodos (Tylocephalum sp.), protozoario parásito (Perkinsus marinus) y Vibrio spp.
VII. CARACTERIZACIÓN DE LA ZONA PARA LA ACTIVIDAD ACUÍCOLA
Consideraciones para la actividad acuícola: En lo general, la actividad acuícola de producción tiene dependencia con los procesos meteorológicos (nortes), por lo que deberán de tenerse en cuenta a la hora de plantear un proyecto. Sin embargo, los parámetros a considerar para la toma de decisiones de que especie cultivar son: Temperatura, salinidad, batimetría, corrientes, y aportes de agua dulce.
Así mismo deberá de tomarse en cuenta para cualquier tipo de cultivo (especialmente el de moluscos) la carga bacteriana y la concentración de metales pesados.
Características del sistema laguna a considerar para la actividad acuícola: La laguna, es recomendada para organismos de preferencia que sean eurihalinos, dada al amplio intervalo de salinidades que en ella se ha llegado a reportar.
6.2 Laguna de Pueblo Viejo
I. UBICACIÓN
La laguna Pueblo Viejo está ubicada en la Región Hidrológica 26 Pánuco, en la cuenca A y subcuenca a, ambas del mismo nombre. La cuenca del río Pánuco se caracteriza por tener un sistema fluvial que va de oeste a este, con una extensión de 510 km a lo largo de varias entidades: la Ciudad de México, Hidalgo, Estado de México, Querétaro, San Luis Potosí, Veracruz y Tamaulipas. El área de la cuenca del río Pánuco es de 88 811 km2, y una precipitación anual hasta de 4 000 mm.
Población aledaña: La laguna de pueblo viejo se localiza en los municipios Pueblo Viejo y Tampico Alto, y una pequeña parte de Ozuluama, Veracruz, en la denominada Región Huasteca. Ocupa una superficie total de 62 954 ha, de las cuales 8 870 ha corresponden al cuerpo de la laguna, y el resto a espacios inundables o terrestres; al norte limita con el Río Pánuco, que establece la frontera de los estados de Veracruz y Tamaulipas; al este están los puntos más altos, determinados de acuerdo con las curvas de nivel, coincidentes en muchos puntos con la carretera federal 180; al sur se sigue el trazo del río Tamacuil y algunos de los escurrimientos que lo alimentan, y al oeste se retoman nuevamente los puntos altos de algunos lomeríos, hasta regresar nuevamente al Pánuco.
Actividades económicas (dentro del cuerpo de agua): La región está caracterizada por la actividad pesquera y la extracción de petróleo. La mayoría de los pescadores consideran la pesca como la principal actividad a la que se dedican, ya que les provee de los ingresos para cubrir cuando menos las necesidades más apremiantes; sin embargo, no es suficiente para cubrir todos los gastos familiares, por lo que algunos miembros de la familia trabajan en otra actividad, generalmente como empleados.
Debido a las condiciones ambientales de esta unidad, a las propiedades del suelo y cercanía con la Laguna de Pueblo Viejo, se presenta una importante ocupación del sitio, tanto para fines agrícolas como de ganadería extensiva, esto ha ocasionado que el paisaje que domine sea de visuales muy abiertas y extendidas donde la percepción del tercer plano en el paisaje es muy lejano. Esta unidad se presenta principalmente al centro del área de estudio ligada a la planicie fluvial. Este sistema cuenta con un Plan de Manejo Pesquero (INAPESCA, 2011), el cual pone a disposición una herramienta importante para la planeación de la actividad pesquera.
II. CARACTERÍSTICA GEOFÍSICAS
Geomorfología: Es una laguna costera asociada con sistemas deltaicos fluviales producidos por sedimentación irregular o subsidencias de superficie que causa la compactación de los efectos de carga. Se forma por barreras arenosas, que envuelven depresiones marginales o intra deltaicas muy someras; deltas de insumo de sedimentos bajos que pueden ser someros y frecuentemente efímeras, lagunas elongadas entre montículos de playa. Son frecuentes a lo largo de los planos deltaicos de las regiones ubicadas en el Golfo de México. La laguna Pueblo Viejo se localiza en la provincia fisiográfica denominada Planicie Costera del Golfo, que a su vez comprende parte de la subprovincia de la Costa Baja, dentro de esta provincia es posible identificar distintas formas del relieve. Se han identificado tres variables que caracterizan a la geometría del relieve: pendiente, altitud media y altura relativa. Se distinguen tres grandes unidades:
I. Lomerío medio, que ocupa porciones onduladas dentro del territorio con alturas relativas mayores a los 50 msnm.
II. Lomerío bajo, con alturas relativas mayores a 10 msnm.
III. Planicies aluviales, que sobresalen por ocupar la mayor parte del territorio; son notorias por tener una pendiente muy suave que alberga los usos de suelo ganaderos y agrícolas; además ocupan la porción inundable que está relacionada con la laguna Pueblo Viejo y el río Tamacuil.
Batimetría: La laguna tiene un talud con pendiente suave, y plataforma amplia, con una profundidad promedio de 1.5 m. El cuerpo de la laguna, está ligada al Río Tamacuil, asimismo se incluyen los bordos creados para la recolección de agua, los cuales tienen un fin principalmente pecuario. Asociado a los cuerpos de agua es posible identificar grandes áreas de vegetación las cuales definen diferentes planos con relación a la altura de la misma.
Corrientes y Mareas: La poca profundidad del sistema, impide una estratificación vertical del sistema, no se presenta tampoco una estratificación horizontal en la laguna. Existen dos épocas que dominan las corrientes en el cuerpo lagunar, con una marcada diferencia en su comportamiento, estas son la época de lluvias (julio-octubre), cuando se presenta mayor influencia en las zonas del noreste y sureste de la laguna, al recibir las descargas de los ríos Pánuco y Tamacuil. Por otro lado, está la época de "nortes" (noviembre-febrero) cuando se presenta la mezcla de la columna de agua por la actividad de los vientos. Así, las lluvias estimulan los mecanismos de producción del sistema y una mayor disponibilidad de alimento.
Composición textural: Las unidades geológicas que se registran en la zona son la lutita-arenisca y aluvial, las cuales corresponden al terciario inferior y al cuaternario, respectivamente.
Aportes: Los aportes provienen de los Ríos Pánuco y Tamacuil, son de tipo aluvial, con mezcla de lodo y arena, provenientes directamente de ríos y tributarios.
III. PARÁMETROS FÍSICO-QUÍMICOS
En el sistema lagunar, los parámetros físico-químicos están íntimamente relacionados con la temporada de lluvias, nortes y de estiaje, con el aporte fluvial de los ríos y escurrimientos provenientes de parte alta de la cuenca.
| PARÁMETRO
| MÍN
| MÁX
| PROMEDIO
|
| Temperatura (ºC)
| *19.0
| **30.0
| 24.4
|
| En temporada de nortes, se registran temperaturas menores a 21 °C, mientras que, en tiempos de lluvia, esta
condición se invierte.
|
| Salinidad (ups)
| **1.2
| *5.0
| 3.4
|
| Los intervalos de salinidad se mantienen constantes durante las dos principales temporadas, (lluvias y nortes)
y durante la época de nortes es cuando se presentan las menores salinidades, estando asociados a cloruros,
por la influencia de los escurrimientos en la parte alta de la cuenca.
|
| Oxígeno (mg/L)
| **3.9
| *7.6
| 5.6
|
| Durante el periodo de nortes se presenta la menor concentración de oxígeno en el cuerpo lagunar.
|
| Ph
| 8
| 8.8
| 8.4
|
| Clorofila a (µg/L)
| 24.3
| 130.1
| 59.88
|
NOTA: * Época de Norte. **En época de lluvias
Impacto ambiental: La zona registra problemas importantes, como son la calidad del agua y de los sedimentos, que afectan el desarrollo de las comunidades bióticas, en particular de los recursos pesqueros. Una de las causas de esta situación son las descargas del Río Pánuco, cuyas aguas se encuentran altamente contaminadas.
Los cambios de usos de suelo, el aumento de la población y la migración hacia las costas, el uso no controlado de agroquímicos, los desechos de industrias como la petrolera y otras, el escaso tratamiento de aguas de desecho de las poblaciones ribereñas, la tala inmoderada de cubiertas vegetales son las principales causas de alteración en la región, con base en los datos con que se cuenta se considera que los cuerpos lagunares del estado de Veracruz están fuertemente impactados, incluyendo en este grupo a la Laguna de Pueblo Viejo, la cual ha resentido la influencia del Río Pánuco y de los desechos industriales y caseros que acarrean sus aguas.
Contaminación: La contaminación de la Laguna, está relacionada directamente con:
1. Acarreos provenientes de la cuenca del Río Pánuco y sus tributarios;
2. Cambios de usos de suelo;
3. Desecho de industrias, incluida la petrolera;
4. Actividad agrícola en las márgenes del Río Pánuco y la Laguna.
Presencia de coliformes en el sistema lagunar promedio anual
| Estación del año y Norma
| Coliformes totales NMP/100 g
| Coliformes fecales NMP/100 g
|
| Lluvias
| 186.0 - 86.8
| 171.0 - 12.8
|
| Nortes
| 49.0 - 15.6
| 11.8 - 4.3
|
Los niveles registrados de cobre (Cu), son bajos y estuvieron dentro lo que establece la normatividad, por lo que este elemento no representa riesgo para la vida acuática y la salud del humano por el uso de los recursos de la laguna Pueblo Viejo. Empero, el Hg, el Pb, el Cd y el Cr, sí representan un peligro para el ecosistema. Los niveles encontrados de estos elementos indican su procedencia de las actividades humanas que se realizan en las áreas circunvecinas al sistema lagunar, además del aporte de los diversos ríos que desembocan en este cuerpo de agua.
IV. LISTADO DE ESPECIES
| Especies nativas representativas del sistema lagunar
|
| Moluscos
| Ostión (Crassostrea virginica)
|
| Crustáceos
| Jaiba (Callinectes rathbunae y C. sapidus)
|
| | Camarón (Litopenaeus setiferus y Farfantepenaeus aztecus)
|
| Peces
| Lebrancha (Mugil curema)
|
| | Lisa (Mugil cephalus)
|
| | Robalo (Centropomus undecimalis)
|
| | Chucumite (Centropomus parallelus)
|
| | Mojarra (Gerres cinereus)
|
| | Sargo (Archosargus probatocephalus)
|
| | Corvina (Cynoscion arenarius, C. nebulosus)
|
Nota: Las especies son aprovechadas por la actividad pesquera.
V. ACTIVIDAD ACUÍCOLA EN EL SISTEMA LAGUNAR
| Especies que se cultivan
| Parámetros Físico-químicos para cultivo.
|
| Ostión
(Crassostrea virginica)
| Temperatura promedio: 27.8 °C
Oxígeno disuelto: 5 mg/L
pH: 7
Salinidad: 23.9 ups
|
| *Tilapias - mojarras (Oreochromis
niloticus)
| Temperatura: 24 a 30 ºC
Oxígeno disuelto: 5 mg/L
pH: 7 - 8
|
NOTA: *Especie introducida y cultivada en la periferia del sistema lagunar.
1. Ostión: La actividad acuícola se desarrolla a través de Cultivo de concha seca y concha verde, para la colecta de semilla del medio. La engorda se realiza trasplantando la concha verde en bancos o zonas propensas para el cultivo.
2. Tilapia nilótica: Actualmente el cultivo de tilapia ha sido a través de estanques. El cultivo de tilapia tiene su biotecnología completa, por lo que cuenta con los insumos necesarios. En la región existen dos centros acuícolas con una capacidad para producir 2.5 millones de crías anuales.
| Especies con potencial de cultivo
(tecnificación)
| Parámetros Físico-químicos para cultivo.
|
| Ostión
(Crassostrea virginica)
| Temperatura promedio: 27.8°C
Oxígeno disuelto: 5 mg/L
pH: 7
Salinidad: 23.9 ups
|
NOTA: **Especie nativa con potencial.
1. Ostión: El cultivo se ha realizado en la laguna y está probado que cuenta con las condiciones para el desarrollo de la especie, se propone como una de las especies con potencial de desarrollo en este cuerpo de agua, considerando los siguientes puntos: a) Especie nativa de este sistema lagunar, b) demanda regional y nacional, c) alto valor económico en la región, y d) actualmente se cuenta con tecnología para producirla en laboratorio. La engorda de esta especie se realiza principalmente a escala rural en la región de distribución natural de la misma, es necesario tecnificar los procesos y mejorar la calidad e inocuidad del producto final.
VI. SANIDAD
Sanidad acuícola: En el sistema lagunar se ha reportado la presencia de: (Cóccidios), Tremátodos (Bucephalus spp.), Céstodos (Tylocephalum sp.), protozoario parásito (Perkinsus marinus) y Vibrio spp.
VII. CARACTERIZACIÓN DE LA ZONA PARA LA ACTIVIDAD ACUÍCOLA
Consideraciones para la actividad acuícola: En lo general, la actividad acuícola de producción tiene dependencia con los procesos meteorológicos (nortes), por lo que deberán de tenerse en cuenta a la hora de plantear un proyecto. Sin embargo, los parámetros a considerar para la toma de decisiones de que especie cultivar son: Temperatura, salinidad, batimetría, corrientes, y aportes de agua dulce.
Así mismo deberá de tomarse en cuenta para cualquier tipo de cultivo (especialmente el de moluscos) la carga bacteriana y la concentración de metales pesados.
Características de la laguna a considerar para la actividad acuícola: La laguna, es recomendada para organismos de preferencia que sean eurihalinos, dada al amplio intervalo de salinidades que en ella se ha llegado a reportar.
7. ARTES DE CULTIVO
7.1 Kreisel
Es un tipo de acuario cuya particularidad es que en su zona central mantiene una forma cilíndrica sin esquinas, en esta zona se induce la generación de corrientes mediante la disposición de la entrada y salida del agua evitando a toda costa la generación de burbujas.
El agua entra por medio de una barra rociadora (A) y se desplaza de manera plana a través del interior de la zona cilíndrica del acuario de esta manera se evita que las medusas se peguen y quedan suspendidas de manera segura en el agua relativamente tranquila de en medio. Posteriormente el agua pasa a través de una pantalla de salida (C) que evita que las medusas se vean atrapadas en el drenaje (B), el agua sale hacia un cubo externo para su filtración y recirculación.
8. ANEXO NORMATIVIDAD
8.1 LEYES
I. Ley de Aguas Nacionales
II. Ley de Bioseguridad de Organismos Genéticamente Modificados
III. Ley de Navegación y Comercio Marítimos
IV. Ley Federal de Sanidad Animal
V. Ley Federal del Mar
VI. Ley General de Pesca y Acuacultura Sustentables
VII. Ley General de Salud
VIII. Ley General de Vida Silvestre
IX. Ley General del Equilibrio Ecológico y la Protección al Ambiente
8.2 REGLAMENTOS
I. Reglamento de Control Sanitario de Productos y Servicios
II. Reglamento de la Ley de Aguas Nacionales
III. Reglamento de la Ley de Bioseguridad de Organismos Genéticamente Modificados
IV. Reglamento de la Ley de Pesca
V. Reglamento de la Ley General del Equilibrio Ecológico y la Protección al Ambiente en Materia de Áreas Naturales Protegidas
VI. Reglamento de la Ley General del Equilibrio Ecológico y la Protección al Ambiente en Materia de Evaluación del Impacto Ambiental
VII. Reglamento de Ley General de Vida Silvestre
8.3 NORMAS OFICIALES MEXICANAS
I. NORMA Oficial Mexicana NOM-001-SEMARNAT-2021, que establece los límites permisibles de contaminantes en las descargas de aguas residuales en cuerpos receptores propiedad de la nación.
II. NORMA Oficial Mexicana NOM-002-SAG/PESC-2013 Para ordenar el aprovechamiento de las especies de camarón en aguas de jurisdicción federal de los Estados Unidos Mexicanos.
III. NORMA Oficial Mexicana NOM-003-SEMARNAT-1997 Establece los límites máximos permisibles de contaminantes para las aguas residuales tratadas que se reúsen en servicios al público.
IV. NORMA Oficial Mexicana NOM-009-SAG/PESC-2015 Que establece el procedimiento para determinar las épocas y zonas de veda para la captura de las diferentes especies de la flora y fauna acuáticas, en aguas de jurisdicción federal de los Estados Unidos Mexicanos.
V. NORMA Oficial Mexicana NOM-011-PESC-1993, para regular la aplicación de cuarentenas, a efecto de prevenir la introducción y dispersión de enfermedades certificables y notificables, en la importación de organismos acuáticos vivos en cualesquiera de sus fases de desarrollo, destinados a la acuacultura y ornato en los Estados Unidos Mexicanos.
VI. NORMA Oficial Mexicana NOM-030-PESC-2000 Que establece los requisitos para determinar la presencia de enfermedades virales de crustáceos acuáticos vivos, muertos, sus productos o subproductos en cualquier presentación y artemia (Artemia spp.), para su introducción al territorio nacional y movilización en el mismo.
VII. NORMA Oficial Mexicana NOM-047-SAG/PESC-2014 Para la identificación del origen de camarones cultivados, de aguas marinas y de esteros, marismas y bahías.
VIII. NORMA Oficial Mexicana NOM-059-SEMARNAT-2010 Protección ambiental-especies nativas de México de flora y fauna silvestres-categorías de riesgo y especificaciones para su inclusión, exclusión o cambio-lista de especies en riesgo.
IX. NORMA Oficial Mexicana NOM-074-SAG/PESC-2014 Para regular el uso de sistemas de exclusión de fauna acuática (SEFA) en unidades de producción acuícola para el cultivo de camarón
en el estado de Sinaloa.
X. NORMA Oficial Mexicana NOM-128-SSA1-1994, Bienes y servicios. Que establece la aplicación de un sistema de análisis de riesgos y control de puntos críticos en la planta industrial procesadora de productos de la pesca.
XI. NORMA Oficial Mexicana NOM-242-SSA1-2009 Productos y servicios. Productos de la pesca frescos, refrigerados, congelados y procesados. Especificaciones sanitarias y métodos de prueba.
XII. NORMA Oficial Mexicana NOM-251-SSA1-2009 Prácticas de higiene para el proceso de alimentos, bebidas o suplementos alimenticios.
8.4 OTROS
Acuerdo por el que se determina la Lista de las Especies Exóticas Invasoras para México.
9. INVENTARIO DE LAS ESPECIES ACUÍCOLAS SUSCEPTIBLES DE REPRODUCCIÓN Y CULTIVO
Además de las especies mencionadas en esta Carta, se enlista la última edición vigente de cada ficha técnica.
ACUACULTURA COMERCIAL
I. ABULÓN ROJO, ver Carta Nacional Acuícola publicada en el DOF el 15/IV/2021 (https://www.gob.mx/inapesca/documentos/carta-nacional-acuicola-2021). Producción (2020): 52,300 kg.
II. BAGRE, ver Carta Nacional Acuícola publicada en el DOF el 15/IV/2021 (https://www.gob.mx/inapesca/documentos/carta-nacional-acuicola-2021). Producción (2020): 1,423,370 kg.
III. CAMARÓN BLANCO DEL PACÍFICO, ver Carta Nacional Acuícola publicada en el DOF el 15/IV/2021 (https://www.gob.mx/inapesca/documentos/carta-nacional-acuicola-2021). Producción (2020): 214,545,584 kg.
IV. CARPA, ver Carta Nacional Acuícola publicada en el DOF el 15/IV/2021 (https://www.gob.mx/inapesca/documentos/carta-nacional-acuicola-2021). Producción (2020): 10,608,402 kg.
V. LANGOSTA DE AGUA DULCE, LANGOSTA AUSTRALIANA, ver Carta Nacional Acuícola publicada en el DOF el 09/IX/2013 (https://www.gob.mx/inapesca/acciones-y-programas/acuacultura-camaron-azul). Producción (2020): 30,460 kg.
VI. LANGOSTINO MALAYO O LANGOSTINO GIGANTE DE AGUA DULCE, ver Carta Nacional Acuícola publicada en el DOF el 06/VI/2012 (https://www.gob.mx/inapesca/acciones-y-programas/acuacultura-langostino-malayo). Producción (2020): 9,539 kg.
VII. MEJILLÓN DEL MEDITERRÁNEO, ver Carta Nacional Acuícola publicada en el DOF el 15/IV/2021 (https://www.gob.mx/inapesca/documentos/carta-nacional-acuicola-2021). Producción (2020): Sin estadística oficial.
VIII. OSTIÓN JAPONÉS, ver Carta Nacional Acuícola publicada en el DOF el 15/IV/2021 (https://www.gob.mx/inapesca/documentos/carta-nacional-acuicola-2021). Producción (2020): 15,601,903 kg de ostión en general.
IX. PECES DE ORNATO, ver Carta Nacional Acuícola publicada en el DOF el 06/VI/2012 (https://www.gob.mx/inapesca/acciones-y-programas/acuacultura-peces-de-ornato). Producción (2020): 55,031 kg.
X. RANA TORO Carta Nacional Acuícola publicada en el DOF el 06/VI/2012 (https://www.gob.mx/inapesca/acciones-y-programas/acuacultura-rana-toro). Producción (2020): Sin estadística oficial.
XI. TILAPIA, ver Carta Nacional Acuícola publicada en el DOF el 15/IV/2021 (https://www.gob.mx/inapesca/documentos/carta-nacional-acuicola-2021). Producción (2020): 96,976,917 kg.
XII. TRUCHA ARCOÍRIS, ver Carta Nacional Acuícola publicada en el DOF el 15/IV/2021 (https://www.gob.mx/inapesca/documentos/carta-nacional-acuicola-2021). Producción (2020): 1,614,890 kg.
ACUACULTURA DE FOMENTO
I. ACHOQUE, ver Carta Nacional Acuícola publicada en el DOF el 15/IV/2021 (https://www.gob.mx/inapesca/documentos/carta-nacional-acuicola-2021).
II. ALMEJA GENEROSA, ALMEJA DE SIFÓN O ALMEJA CHILUDA, ver Carta Nacional Acuícola publicada en el DOF el 15/IV/2021 (https://www.gob.mx/inapesca/documentos/carta-nacional-acuicola-2021).
III. ALMEJA MANO DE LEÓN, ver Carta Nacional Acuícola publicada en el DOF el 15/IV/2021 (https://www.gob.mx/inapesca/documentos/carta-nacional-acuicola-2021).
IV. CALLO DE HACHA, ver Carta Nacional Acuícola publicada en el DOF el 15/IV/2021 (https://www.gob.mx/inapesca/documentos/carta-nacional-acuicola-2021).
V. CAMARÓN AZUL, ver Carta Nacional Acuícola publicada en el DOF el 15/IV/2021 (https://www.gob.mx/inapesca/documentos/carta-nacional-acuicola-2021).
VI. CATÁN, ver Carta Nacional Acuícola publicada en el DOF el 06/VI/2012 (https://www.gob.mx/inapesca/acciones-y-programas/acuacultura-catan).
VII. COBIA O ESMEDREGAL, ver Carta Nacional Acuícola publicada en el DOF el 06/VI/2012 (https://www.gob.mx/inapesca/acciones-y-programas/acuacultura-cobia-o-esmedregal).
VIII. CORVINA OCELADA O ROJA, RONCADOR, CORVINETA OCELADA O TAMBOR ROJO, ver Carta Nacional Acuícola publicada en el DOF el 06/VI/2012 (https://www.gob.mx/inapesca/acciones-y-programas/acuacultura-corvina-ocelada).
IX. HUACHINANGO DEL PACÍFICO. PARGO DE SEDA, PARGO GRINGO O PARGO ROJO, ver Carta Nacional Acuícola publicada en el DOF el 15/IV/2021 (https://www.gob.mx/inapesca/documentos/carta-nacional-acuicola-2021).
X. JUREL, JUREL DE CASTILLA, JUREL ALETA AMARILLA, JUREL DE CALIFORNIA, MEDREGAL AMARILLO, MEDREGAL COLA AMARILLA, ver Carta Nacional Acuícola publicada en el DOF el 06/VI/2012 (https://www.gob.mx/inapesca/acciones-y-programas/acuacultura-jurel).
XI. LENGUADO DE CALIFORNIA O HUARACHA, ver Carta Nacional Acuícola publicada en el DOF el 06/VI/2012 (https://www.gob.mx/inapesca/acciones-y-programas/acuacultura-lenguado-de-california).
XII. OSTIÓN DE PLACER O DE CORTÉS, ver Carta Nacional Acuícola publicada en el DOF el 15/IV/2021 (https://www.gob.mx/inapesca/documentos/carta-nacional-acuicola-2021).
XIII. OSTIÓN DEL ESTE, ver Carta Nacional Acuícola publicada en el DOF el 15/IV/2021 (https://www.gob.mx/inapesca/documentos/carta-nacional-acuicola-2021).
XIV. PARGO CANANÉ, ver Carta Nacional Acuícola publicada en el DOF el 15/IV/2021 (https://www.gob.mx/inapesca/documentos/carta-nacional-acuicola-2021).
XV. PARGO LUNAREJO, PARGO FLAMENCO, HUACHINANGO, PARGO DE ALETA NEGRA, PARGO CHIVATO O PARGO PRIETO, ver Carta Nacional Acuícola publicada en el DOF el 09/IX/2013 (https://www.gob.mx/inapesca/acciones-y-programas/acuacultura-pargo-lunarejo).
XVI. PEJELAGARTO, PEZ ARMADO, MACHORRA, PEZ GASPAR Carta Nacional Acuícola publicada en el DOF el 06/VI/2012 (http://www.gob.mx/inapesca/acciones-y-programas/acuacultura-pejelagarto).
XVII. PEPINO DE MAR EN EL CARIBE, ver Carta Nacional Acuícola publicada en el DOF el 09/IX/2013 (https://www.gob.mx/inapesca/acciones-y-programas/acuacultura-pepino-de-mar).
XVIII. PEPINO DE MAR EN EL PACÍFICO, ver Carta Nacional Acuícola publicada en el DOF el 09/IX/2013 (https://www.gob.mx/inapesca/acciones-y-programas/acuacultura-pepino-de-mar-del-pacifico).
XIX. PESCADO BLANCO, ver Carta Nacional Acuícola publicada en el DOF el 15/IV/2021 (https://www.gob.mx/inapesca/documentos/carta-nacional-acuicola-2021).
ESPECIES CON POTENCIAL ACUÍCOLA
I. ACOCIL, RECULILLAS, CAMARÓN BURRITO O RECULADOR, ver Carta Nacional Acuícola publicada en el DOF el 06/VI/2012 (http://www.gob.mx/inapesca/acciones-y-programas/acuacultura-acocil).
II. CAMARÓN BLANCO DEL GOLFO DE MÉXICO, ver Carta Nacional Acuícola publicada en el DOF el 15/IV/2021 (https://www.gob.mx/inapesca/documentos/carta-nacional-acuicola-2021).
III. CAMARÓN ROSADO DEL GOLFO DE MÉXICO, ver Carta Nacional Acuícola publicada en el DOF
el 15/IV/2021 (https://www.gob.mx/inapesca/documentos/carta-nacional-acuicola-2021).
IV. CARACOL ROSADO, ver Carta Nacional Acuícola publicada en el DOF el 06/VI/2012 (http://www.gob.mx/inapesca/acciones-y-programas/acuacultura-caracol-rosado).
V. MOJARRA CASTARRICA, MOJARRA COLORADA, MOJARRA CRIOLLA, MOJARRA RAYADA Y MOJARRA LATINOAMERICANA, ver Carta Nacional Acuícola publicada en el DOF el 09/IX/2013 (http://www.gob.mx/inapesca/acciones-y-programas/acuacultura-mojarra-castarrica).
VI. TENGUAYACA, TENHUAYACA, BLANCO DEL PETÉN, MOJARRA BLANCA, MOJARRA BOCONA O BAYSNOOK, ver Carta Nacional Acuícola publicada en el DOF el 09/IX/2013 (http://www.gob.mx/inapesca/acciones-y-programas/acuacultura-tenguayaca).
VOCACIÓN Y POTENCIAL ACUÍCOLA
I. SISTEMA LAGUNAR CARMEN-PAJONAL-MACHONA, ver Carta Nacional Acuícola publicada en el DOF el 09/IX/2013 (http://www.gob.mx/inapesca/acciones-y-programas/acuacultura-sistema-lagunar-carmen-pajonal-machona).
ARTES DE CULTIVO
I. BALSAS, ver el apartado Artes de Cultivo de la Carta Nacional Acuícola publicada en el DOF el 06/VI/2012 (https://www.gob.mx/inapesca/acciones-y-programas/acuacultura-sistemas-de-cultivo-para-moluscos-bivalvos).
II. CANALETAS ACUACULTURA, ver el apartado Artes de Cultivo de la Carta Nacional Acuícola publicada en el DOF el 15/IV/2021 (https://www.gob.mx/inapesca/documentos/carta-nacional-acuicola-2021).
III. CANASTA AUSTRALIANA, ver el apartado Artes de Cultivo de la Carta Nacional Acuícola publicada en el DOF el 15/IV/2021 (https://www.gob.mx/inapesca/documentos/carta-nacional-acuicola-2021).
IV. CANASTAS OSTRÍCOLAS O NESTIER, ver el apartado Artes de Cultivo de la Carta Nacional Acuícola publicada en el DOF el 06/VI/2012 (https://www.gob.mx/inapesca/acciones-y-programas/acuacultura-canastas-ostricolas).
V. COSTALES, ver el apartado Artes de Cultivo de la Carta Nacional Acuícola publicada en el DOF el 15/IV/2021 (https://www.gob.mx/inapesca/documentos/carta-nacional-acuicola-2021).
VI. DOMO, ver el apartado Artes de Cultivo de la Carta Nacional Acuícola publicada en el DOF el 09/IX/2013 (https://www.gob.mx/inapesca/acciones-y-programas/acuacultura-domo).
VII. ESTANQUE RÚSTICO, ver el apartado Artes de Cultivo de la Carta Nacional Acuícola publicada en el DOF el 06/VI/2012 (https://www.gob.mx/inapesca/acciones-y-programas/acuacultura-estanque-rustico).
VIII. ESTANQUES O CANAL DE FLUJO CONTINUO ("RACEWAYS"), ver el apartado Artes de Cultivo de la Carta Nacional Acuícola publicada en el DOF el 06/VI/2012 (https://www.gob.mx/inapesca/acciones-y-programas/acuacultura-estanques-o-canales-de-flujo-continuo-raceways).
IX. JAULA ENGORDA HUACHINANGO-PARGO, ver el apartado Artes de Cultivo de la Carta Nacional Acuícola publicada en el DOF el 15/IV/2021 (https://www.gob.mx/inapesca/documentos/carta-nacional-acuicola-2021).
X. JAULAS FLOTANTES DE BLOQUES, ver el apartado Artes de Cultivo de la Carta Nacional Acuícola publicada en el DOF el 06/VI/2012 (https://www.gob.mx/inapesca/acciones-y-programas/acuacultura-jaulas-flotantes-de-bloques).
XI. JAULAS FLOTANTES, ver el apartado Artes de Cultivo de la Carta Nacional Acuícola publicada en el DOF el 06/VI/2012 (https://www.gob.mx/inapesca/acciones-y-programas/acuacultura-jaulas-flotantes).
XII. LÍNEA MADRE O LARGA, ver el apartado Artes de Cultivo de la Carta Nacional Acuícola publicada en el DOF el 06/VI/2012 (https://www.gob.mx/inapesca/acciones-y-programas/acuacultura-sistemas-de-cultivo-para-moluscos-bivalvos).
XIII. LINTERNA CILÍNDRICA MULTINIVEL "TIPO JAPONESA", ver el apartado Artes de Cultivo de la Carta Nacional Acuícola publicada en el DOF el 06/VI/2012 (https://www.gob.mx/inapesca/acciones-y-programas/acuacultura-linterna-cilindrica-multinivel-tipo-japonesa).
XIV. MALLA TUBULAR "CALCETINES", ver el apartado Artes de Cultivo de la Carta Nacional Acuícola publicada en el DOF el 15/IV/2021 (https://www.gob.mx/inapesca/documentos/carta-nacional-acuicola-2021).
XV. MÓDULO DE LÁMINAS PARA ABULÓN, ver el apartado Artes de Cultivo de la Carta Nacional Acuícola publicada en el DOF el 06/VI/2012 (https://www.gob.mx/inapesca/acciones-y-programas/acuacultura-modulo-de-laminas-para-abulon).
XVI. PRENGORDA DE ABULÓN, ver el apartado Artes de Cultivo de la Carta Nacional Acuícola publicada en el DOF el 15/IV/2021 (https://www.gob.mx/inapesca/documentos/carta-nacional-acuicola-2021).
XVII. RACKS O ESTANTE, ver el apartado Artes de Cultivo de la Carta Nacional Acuícola publicada en el DOF el 06/VI/2012 (https://www.gob.mx/inapesca/acciones-y-programas/acuacultura-sistemas-de-cultivo-para-moluscos-bivalvos).
XVIII. SARTAS, ver el apartado Artes de Cultivo de la Carta Nacional Acuícola publicada en el DOF el 06/VI/2012 (https://www.gob.mx/inapesca/acciones-y-programas/acuacultura-sartas).
XIX. TANQUES CIRCULARES DE CONCRETO, ver el apartado Artes de Cultivo de la Carta Nacional Acuícola publicada en el DOF el 06/VI/2012 (https://www.gob.mx/inapesca/acciones-y-programas/acuacultura-tanque-circular-de-concreto).
XX. TANQUES CIRCULARES DE GEOMEMBRANA, ver el apartado Artes de Cultivo de la Carta Nacional Acuícola publicada en el DOF el 06/VI/2012 (https://www.gob.mx/inapesca/acciones-y-programas/acuacultura-tanque-circular-de-geomembrana).
XXI. TUBO DE ABS, ver el apartado Artes de Cultivo de la Carta Nacional Acuícola publicada en el DOF el 09/IX/2013 (https://www.gob.mx/inapesca/acciones-y-programas/acuacultura-tubo).
10. BIBLIOGRAFÍA
Caballito de mar del Atlántico
Vite-García, N. et al., 2017. Avances en el cultivo de Hippocampus spp.(Teleostei: Syngnathidae): investigaciones en el Siglo XXI. Lat. Am. J. Aquat. Res., 45(1): 1-17,2017.
Manual para el cultivo del caballito de mar Hippocampus erectus. Programa de Investigaciones en Ecología y Cultivo de Especies Marinas de Ornato (PIECEMO). UMDI, UNAM. Sisal, Yucatán, México). (piecemo.sisal.unam.mx/cgi-bin/dl.cgi?id=132).
Caballito de mar del Pacífico
Álvarez J.P., Blanco A., Silva C. & M. Planas. 2009. Proximate biochemical composition and enzymatic activities in eggs of farmed seahorse Hippocampus guttulatus and H. hippocampus. World Aquaculture Society, World Aquaculture 2009, Veracruz, México.
Amaral-Ruíz M.J. 2013. Tolerancia térmica en los caballitos juveniles de Hippocampus erectus y su efecto sobre el crecimiento. Tesis de Licenciatura, Universidad de Guadalajara. 73 p.
Aranda-Mena O.S. 2000. Lista sistemática de los peces del arrecife de bahía de Banderas, Jalisco-Nayarit, México. Tesis de Licenciatura, Universidad de Guadalajara. 64 p.
Avendaño-Ibarra R., R. Funes-Rodríguez, A. Hinojosa-Medina, R. González-Armas & G. Aceves-Medina. 2004. Seasonal abundance of fish larvae in a subtropical lagoon in the west coast of the Baja California Peninsula. Estuarine, Coastal and Shelf Science. 61: 125 - 135 p.
Balcázar J.L., A. Gallo-Bueno, M. Planas & J. Pintado. 2010a. Isolation of Vibrio alginolyticus and Vibrio splendidus from captive-bred seahorses with disease symptoms. Antonie van Leeuwenhoek. 97: 207 - 210 p.
Balcázar J.L., N.M. Lee, J. Pintado & M. Planas. 2010b. Phylogenetic characterization and in situ detection of bacterial communities associated with seahorses (Hippocampus guttulatus) in captivity. Systematic and Applied Microbiology. 33: 71 - 77 p.
Balcázar J.L., S. Loureiro, Y.J. Da Silva, J. Pintado & M. Planas. 2010c. Identification and characterization of bacteria with antibacterial activities isolated from seahorses (Hippocampus guttulatus). The Journal of Antibiotics. 63: 271 - 274 p.
Balcázar J.L., M. Planas & J. Pintado. 2011. Mycobacterium species in seahorse with tail rot. Emerging Infectious Diseases. 17: 1770 - 1772 p.
Balcázar J.L., M. Planas & J. Pintado. 2012a. Oceanibacterium hippocampi gen. Nov., sp. nov., isolated from cutaneous mucus of wild seahorses (Hippocampus guttulatus). Antonie van Leeuwenhoek. 102: 187 - 191 p.
Balcázar J.L., M. Planas & J. Pintado. 2012b. Vibrio inhibens sp. nov., a novel bacterium with inhibitory activity agains Vibrio species. Journal of Antibiotics. 0: 1 - 5 p.
Baum J.K. & A.C.J. Vincent. 2005. Magnitude and inferred impacts of the seahorse trade in Latin America. Environmental Conservation. 32 (4) 305 p.
Baum J.K., J.J. Meeuwig & A.C.J. Vicent. 2003. By catch of lined seahorses (Hippocampus erectus) in a Gulf of Mexico shrimp trawlf ishery. FisheriesBulletin. 101: 721 - 731.
Bisso-Bustamante F.L. 2006. Reproducción de Hippocampus ingens Girard, 1859 en cautiverio. Tesis de Ingeniería, Universidad Nacional Federico Villarreal. 72 p.
Blanco A., A. Nozzi, M. Planas, O. Carnevali, I. Buttino & I. Olivotto. 2010. Cultured harpacticoid and calanoid copepods as potential live prey in Hippocampus reidi aquaculture: A short term feeding study. European Aquaculture Society, Aquaculture Europe, Porto, Portugal.
Blanco A., P. Quintas & M. Planas. 2011a. Catabolic sources in the early development of the Long-Snouted seahorse Hippocampus guttulatus under starving conditions. 5th International Zoo and Aquarium Symposium The Husbandry, Management and Conservation of Syngnathida. Chicago, Estados Unidos.
Blanco A., P. Quintas & M. Planas. 2011b. Enhacement in the rearing of the seahorse Hippocampus guttulatus by feeding on copepods. 5th International Zoo and Aquarium Symposium The Husbandry, Management and Conservation of Syngnathida. Chicago, Estados Unidos.
Blanco A. 2014. Rearing of the seahorse Hippocampus guttulatus: Key factors involved in growth and survival. Tesis de Doctorado, Universitat de les Illes Balears. 289 p.
Cabrera A. 2010. Reproducción y levante del caballito de mar. Acuario Mundo Marino, Santa Marta. 19 - 24 p.
Casey, S. P., Hall, H. J., Stanley, H. F., & Vincent, A. C. (2004). The origin and evolution of seahorses (genus Hippocampus): a phylogenetic study using the cytochrome b gene of mitochondrial DNA. Molecular Phylogenetics and Evolution, 30(2), 261-272.
Castellanos-Galindo G.A., J.R. Cantera, S. Esponosa & L.M. Mejía-Ladino. 2011. Use of local ecological knowledge, scientist´s observations and grey literature to assess marine species at risk in a tropical eastern Pacific estuary. Aquatic Conservation: Marine and Freshwater Ecosystems. 21: 37 - 48 p.
Cervantes-Duarte, R. and F. J. García-Romero. 2016. Características hidrográficas en el litoral de bahía Magdalena, BCS, México durante El Niño 2015. CICIMAR Oceánides. 31:9-19.
Chamorro A. & M. Planas. 2007. Diseño de acuarios para mantenimiento y reproducción en cautividad del caballito de mar Hippocampus guttulatus Cuvier 1829. XI Congreso Nacional de Acuacultura, Vigo, España.
Chen L., X. Wang & B. Huang. 2015. The genus Hippocampus - A review on traditional medicinal uses, chemical constituents and pharmacological properties. Journal of Ethnopharmacology. 162: 104 - 111 p.
Choo, C. K. and H. C. Liew. 2005. Explotation and trade in seahorses in Peninsular Malaysia. Malayan Nature Jorunal. 57:57-66.
CITES. 2000. Conservación de signátidos y otros miembros de la familia Syngnathidae. Doc. AC. 16.19. 5 p.
CITES. 2002a. Conservación de los caballitos de mar y otros miembros de la familia Syngnathidae. CoP12 Doc. 43. 20 p.
CITES. 2002b. Examen de las propuestas de enmiendas a los Apéndices I y II. CoP12 Com. I Rep. 12 (Rev.). 5 p.
CITES. 2004. Signátidos y otros miembros de la familia Syngnathidae (decisión 12.54) - Informe del grupo de trabajo. AC20 Doc. 17. 5 p.
CITES. 2005. Informes de los representantes regionales; América del Norte. SC53 Doc. 38.5 (Rev. 2). 16 p.
CONACYT. Agencia Informativa. El potencial biotecnológico del caballito de mar. La Paz, Baja California Sur. 6 de febrero de 2017. (http://conacytprensa.mx/index.php/ciencia/mundo-vivo/12830-el-potencial-biotecnológico-del caballito-de-mar#offcanvas) Correira M., Palma J., Koldewey H. & J.P. Andrade. 2014. The use of non-invasive tool for capture-recapture studies on a seahorse Hippocampus guttulatus population. Journal of Fish Biology. 84; 872 - 884 p.
DOF (Diario Oficial de la Federación). 2002. Norma Oficial Mexicana NOM-059-ECOL-2001, Protección ambiental-Especies nativas de México de flora y fauna silvestres-Categorías de riesgo y especificaciones para su inclusión, exclusión o cambio-Lista de especies en riesgo. Diario Oficial de la Federación. 85 p.
DOF (Diario Oficial de la Federación). 2010. Norma Oficial Mexicana NOM-059-SEMARNAT-2010, Protección ambiental-Especies nativas de México de flora y fauna silvestres-Categorías de riesgo y especificaciones para su inclusión, exclusión o cambio-Lista de especies en riesgo. Diario Oficial de la Federación. 78 p.
DOF (Diario Oficial de la Federación). 2016. Última Reforma a la Ley General de Vida Silvestre 19-12-2016. Diario Oficial de la Federación. 71 p.
DOF (Diario Oficial de la Federación). 2017. Última Reforma a la Ley general del Equilibrio Ecológico y la Protección al Ambiente 24-01-2017. Diario Oficial de la Federación. 130 p.
Encomendero E., J. Merino, A. Vásquez & F.del R. Azareño. 2011. Fecundidad, supervivencia y crecimiento del caballito de mar Hippocampus ingens (Pisces: Syngnathidae), en condiciones de laboratorio. Pueblo Continente. 22: 159 - 166 p.
Faílde L.D., Castelo M., Bermúdez R., Losada A.P., Vilar A., Planas M., Quiroga M.I. 2008. Micobacteriosis en caballos de mar (Hippocampus guttulatus) criados en cautividad. XX Reunión de la Sociedad Española de Anatomía Patológica Veterinaria. La Palma, Spain.
FAO. 1990. Brief introduction to mariculture of five selected species in China. FAO. 39 p.
FAO. 2009. Cultured Aquatic Species Information Programme; Hippocampus comes (Cantor, 1849). FAO. 7 p.
Faulkner, D.J. 2002. Marine Natural products. Natural Products Report, 19: 1 - 48 p.
Felício A.K.C., I.R. Rosa, A. Souto & R.H.A. Freitas. 2006. Feeding behavior of the long snout seahorse Hippocampus reidi Ginsburg, 1933. Japan Ethological Society and Springer. 24: 219 - 225 p.
Filiz H. & E. Taskavak. 1012. Field surveys on recent situation of seahorses in Turkey. Biharean Biologist. 6: 55 - 60 p.
Flores-Zavala R.A. 2011. Conducta agonística en Hippocampus erectus: el efecto del sexo, proporción sexual y tamaño de los individuos. Tesis de Licenciatura, Universidad Michoacana de San Nicolás de Hidalgo. 52 p.
Foster S.J. &Vincent A.C.J. 2004. Life history and ecology of seahorses: implications for conservation and management. Journal of Fish Biology: 65; 1 - 61.
Foster S.J. 2004. Case study: Hippocampus spp. Project Seahorse. NDF Workshop Case Studies. 19 p.
Garcia L.M.B., G.V. Hilomen-Garcia, F.T. Celino, T.T. Gonzales & R.J. Maliao. 2012. Diet composition and feeding periodicity of the seahorse Hippocampus barbouri reared in illuminated sea cages. Aquaculture. 358-359: 1 - 5 p.
Giles, B. G., T. S. Ky, D. H. Hoang and A. C. J. Vincent. 2005. The catch and trade of seahorses in Vietnam. Biodiversity and Conservation. 00:0-0.
Hammer O., D.A.T. Harper& D. Ryan. 2001. Past: Paleontological statistics software package for education and data analysis. Palaeontología Electrónica, 4(1): 9.
Hattori T., Adachi K., Shizuri Y. 1997. New agelasine compound from the marine sponge Agelas mauritiana as an antifouling substance against macroalgae. Journal of Natural Products. 60: 411 - 413 p.
Hattori T., Adachi K., Shizuro Y. 1998. New ceramide from Marine Sponge Haliclona koremella and
Related Compounds as Antifouling Substances against Macroalgae. Journal of Natural Products. 61: 823 - 826 p.
Hellio C., M. Tsoukatou, M. Jean-Philippe, N. Aldred, C. Beaupoil, A.S. Clare, C. Vagias & V. Roussis. 2005. Inhibitory effects of Mediterranean sponge extracts and metabolites on larval settlement of barnacle Balanus amphitrite. Marine Biotechnology. 7: 297-305 p.
IFAW. 2002. Caballo de Mar (Genero Hippocampus). IFAW. 2 p.
IFAW. 2004. Taller de hipocampos facilita la aplicación de decisiones en CITES. IFAW. 12 p.
IUCN. 2006. 2006 IUCN Red List of Threatened Species. www.iucnredlist.org.
Jiménez-Illescas A.R., M. Obeso-Nieblas & D.A. Salas-de León. 1997. Oceanografía física de la Bahía de La Paz, B.C.S. 31-42. En: Urbán, R.J. & M.R. Ramírez (Eds.). La Bahía de La Paz, investigación y conservación. UABCS - CICIMAR - SCRIPPS. 345 p.
Jones A.T., P. Dutton & R.E. Snodgrass. 1988. Reoccurrence of the Pacific Seahorse, Hippocampus ingens, in San Diego Bay. California Fish and Game. 74: 236 - 238 p.
Koldewey, H. J. 2005. Syngnathid husbandry in public aquariums. Project Seahorse. 137.
Kumaravel K., S. Ravichandran, T. Balasubramanian & L. Sonneschein. 2012. Seahorses - A source of traditional medicine. Natural Product Research: Formerly Natural Product Letters. 26-24: 2330 - 2334 p.
Lawson J.M., S.J. Foster, A.C.O. Lim, V.C. Chong & A.C.J. Vincent. 2015. Novel life-history data for threatened seahorses provide insight into fishery effects. Journal of Fish Biology. 86: 1 - 15 p.
LePage V., Young J., Dutton C.J., Crawashaw G., Paré J.A., Kummrow M., McLelland D.J., Huber P., Young K., Russell S., Al-Hussinee L., Lumsden J.S. 2015. Diseases of captive yellow seahorse Hippocampus kuda Bleker, pot-bellied seahorse Hippocampus abdominales Lesson and weedy seadragon Phyllopteryx taeniolatus (Lacépéde). Journal of Fish Diseases. 38. 439 - 450 p.
López A., B.G. Pardo, P. Martínez & C. Bouza. 2007. Análisis de diversidad genética mediante marcadores microsatélite en poblaciones gallegas de la especie amenazada de caballito de mar Hippocampus guttulatus.
Lourie S.A., J.C. Pritchard, S.P. Casey, S.K. Truong, H.J. Hall & A.C.J. Vincent. 1999. The taxonomy of Vietnam's exploited seahorses (family Syngnathidae). Biological Journal of the Linnean Society. 66: 231 - 256 p.
Lourie S.A., S.I. Foster, W.T.C. Ernest & A.C.I. Vincent. 2004. A guide to the identification of Seahorses. University of British Columbia and WorldWildlifeFund. 114 p.
Lourie S.A., D.M. Green & A.C.J. Vincent. 2005. Dispersal, habitat differences, and comparative phylogeography of Southeast Asian seahorses (Syngnathidae: Hippocampus). Molecular Ecology. 14: 1073 - 1094 p.
Lourie S. 2003. Measuring seahorses. Project Seahorse Technical Report No.4 Version 1.0. Project Seahorse, University of British Columbia. 15 p.
Lourie, S. A., R. A. Pollom and S. J. Foster. 2016. A global revision of the Seahorses Hippocampus Rafinesque 1810 (Actinopterygii: Syngnathiformes): Taxonomy and biogeography with recommendations for further research. Zootaxa. 4146:001-066.
Marcus J.E., M.A. Samoilys, J.J. Meeuwig, Z.A.D. Villongco & A.C.J. Vincent. 2007. Benthic status of near-shore fishing grounds in the central Philippines and associated seahorses densities. Marine Pollution Bulletin. 54: 1483 - 1494 p.
Margalef, R. 1974. Ecología. Editorial Omega, Barcelona. 951 p.
Martínez-Cárdenas L. 2010. Cultivo de caballo marino Hippocampus abdominalis, un caso de estudio. (Parte 1). Revista Fuente. 2: 24 - 30 p.
Martínez-Cárdenas L. 2011. Cultivo de caballo marino Hippocampus abdominalis, un caso de estudio. (Parte 2). Revista Fuente Año 3 No. 6, 42 - 45 p.
Martins M.L., Mouriño J.L.P., Fezer G.F., Buglione-Neto C.C., García P., Silva B.C., Jotobá A., Vieira F.N. 2010. Isolation and experimental infection with Vibrio alginolyticus in the sea horse, Hippocampus reidi Ginsburg, 1933 (Osteichthyes: Syngnathidae) in Brazil. Brazil Journal of Biology. 70: 205 - 209 p.
McPherson J.M. & A.C.J. Vincent. 2004. Assessing East African trade in seahorse species as a basis for conservation under international controls. Aquatic conservation: Marine and freshwater ecosystems. 14: 521 - 538.
Melo-Valencia A.F., G.H. Ospina-Salazar, J. Gómez-León & F.A. Cortés-Pineda. 2013. Efecto de la salinidad en la supervivencia y crecimiento de crías de caballito de mar Hippocampus reidi Ginsburg en cautiverio. Boletín de Investigaciones Marinas y Costeras. 42: 193 - 201 p.
Molina L., J. Socorro, R. Herrera, F. Otero, P. Villares, H. Fernández-Palacios & M. Izquierdo. 2007. Experiencias preliminares de cultivo de crías de Hippocampus hippocampus (Linnaeus, 1758) en Gran Canaria.
Morgan S.K. & S.A. Lourie. 2006. Threatened fishes of the world: Hippocampus comes Cantor 1850 (Syngnathidae). Environmental Biology of Fishes. 75: 311 - 313 p.
Morgan S.K. & A.C.J. Vincent. 2007. The ontogeny of habitat associations in the tropical tiger tail seahorse Hippocampus comes Cantor, 1850. Journal of Fish Biology. 71: 701 - 724 p.
Naud M.J., J.M.R. Curtis, L.C. Woodall & M.B. Gaspar. 2009. Mate choice, operational sex ratio, and social promiscuity in a wild population of the long-snouted seahorse Hippocampus guttulatus. Behavioral Ecology. 20: 160 - 164 p.
Nenciu, M. I., V. Coatu, A. Oros, D. Rosioru. D. Tiganus and N. Rosoiu. 2014. Pollutant bioacucumulation in the long-snouted seahorse at the romanian coast. Journal of Environmental Protection and Ecology. 15:1650-1659.
Olivotto, I., M. Planas, N. Simoes, G.J. Holt, M.A. Aavella, R. Calado. 2011. Advances in breeding and rearing marine ornamentals. Journal of the World Aquaculture Society, 42:135-166.
Ortega-Salas A.A. & H. Reyes-Bustamante. 2006. Fecundity, survival, and growth of the seahorse Hippocampus ingens (Pisces: Syngnathidae) under semi-controlled conditions. Revista de Biología Tropical. 54: 1099 - 1102 p.
Ortiz-Aguirre I. 2012. Actividad biológica de esponjas y su relación con la complejidad de la comunidad bentónica en la bahía de La Paz, B.C.S., México. Tesis de Maestría, Centro Interdisciplinario de Ciencias Marinas. 112 p.
Ortiz-Aguirre I. 2018. Consideraciones sobre el estado actual de Hippocampus ingens para su aprovechamiento sostenible en la bahía de La Paz, Baja California Sur, México. Tesis de Doctorado. Universidad Autónoma de Baja California Sur. 79 p.
Ortiz-Aguirre I., Rangel-Dávalos C. & J.M. Pacheco-Vega. 2018. Efecto del enriquecimiento del alimento en la supervivencia de alevines de Hippocampus ingens Girard, 1858 bajo condiciones semicontroladas. CICIMAR Oceánides. 33 (1): 25 - 32 pp.
Ospina-Salazar, G.H. et al, 2011. Avances en la reproducción y mantenimiento de peces marinos ornamentales. INVEMAR. Santa Marta, Colombia 50% Mar (oceandocs.org).
Otero F., Molina L., Socorro J., Herrera R., Villares P., Monroy M., Fernández-Palacios H. & M. Izquierdo. 2007. Efecto de la primera alimentación en la supervivencia y el crecimiento de crías de caballito de mar, Hippocampus hippocampus (Linnaeus, 1758). XI Congreso Nacional de Acuacultura, Vigo, España.
Perante N.C., Pajaro M.G. & A.C.J. Vincent. 1996. Demographics of the seahorse Hippocampus comes in the central Philippines. En; Morton B. (Ed.). The Marine Biology of the South China Sea. Proceedings of the third international conference on the Marine Biology of the South China Sea.
Perante N.C., Päjaro M.G., Meeuwig J.J. & A.C.J. Vincent. 2002. Biology of a seahorse species, Hippocampus comes in the central Philippines. Journal of Fish Biology. 60: 821-837.
Planas M. & P. Quintas. 2009. Morphotypes and size estimation in eggs of the long-snouted seahorse Hippocampus guttulatus (Project Hippocampus). World Aquaculture Society, World Aquaculture 2009, Veracruz, México.
Planas M., A. Chamorro, P. Quintas & J.L. Balcázar. 2008a. Maturation of long-snouted seahorse Hippocampus guttulatus females under cultive conditions. European Aquaculture Society, Special Pub. 37, Aquaculture Europe 2008, Krakow (Poland).
Planas M., A. Chamorro, P. Quintas & A. Vilar. 2008b. Establishment and maintenance of threatened long-snouted seahorse, Hippocampus guttulatus, broodstock in captivity. Aquaculture. 283: 18 - 28 p.
Planas M., P. Quintas, A. Chamorro, A. López, C. Bouza & J.L. Balcázar. 2008c. Reproductive behavior of the long-snouted seahorse Hippocampus guttulatus under culture conditions. European Aquaculture Society, Special Pub. 37, Aquaculture Europe 2008, Krakow, Polonia.
Planas M., Quintas P. & A. Chamorro. 2009a. Growth of adult seahorses Hippocampus guttulatus fed exclusively on enriched adult Artemia (Project Hippocampus). World Aquaculture Society, World Aquaculture 2009, Veracruz, México.
Planas M., Quintas P., Chamorro A. & J.L. Balcázar. 2009b. Husbandry and rearing of the seahorse Hippocampus guttulatus (Project Hippocampus). World Aquaculture Society, World Aquaculture 2009, Veracruz, México.
Planas M., Chamorro A. & P. Quintas. 2010a. Induced seasonal shifting in maturation of seahorse Hippocampus guttulatus females. European Aquaculture Society, Aquaculture Europe, Porto, Portugal.
Planas M., Quintas P. & A. Chamorro. 2010b. Effect of temperature and photoperiod on female maturation in European seahorses. European Aquaculture Society, Aquaculture Europe, Porto, Portugal.
Planas M., Quintas P., Chamorro A. & C. Silva. 2010c. Female maturation, egg characteristics and fatty acids profile in the seahorse Hippocampus guttulatus. Animal Reproduction Scinece. 122: 66 - 72 p.
Planas M., A. Blanco, A. Chamorro, S. Valladares & J. Pintado. 2012. Temperature-induced changes of growth and survival in the early development of the seahorse Hippocampus guttulatus. Journal of Experimental Marine Biology and Ecology. 438: 154 - 162 p.
Planas M., A. Chamorro & P. Quintas. 2013. Effect of photoperiod and temperature on female maturation in the seahorse Hippocampus guttulatus. Aquaculture. 388-391: 147 - 152 p.
Planas M. 2012. Proyecto Hippocampus: un puente entre la acuacultura y la conservación de la biodiversidad marina, En: Foro Rec. Mar. Ac. Rías Gal. Rey-Méndez M., C. Lodeiros, J. Fernández-Casal & A. Guerra (Eds.). 13: 81 - 92 p.
Pontes M. 1999. El caballito de mar. Aquanet. 9: 6-9.
Quintas P., A. Chamorro, S. Piñeiro, I. Medina & M. Planas. 2007. Producción de Artemia para la alimentación de caballito de mar Hippocampus guttulatus Cuvier 1829 en cautividad. XI Congreso Nacional de Acuacultura. Vigo, España.
Quintas P., Planas M. & J. Purser. 2010. The effect of Artemia enrichment on the rearing of the pot-bellied seahorse Hippocampus abdominalis. European Aquaculture Society, Aquaculture Europe, Porto, Portugal.
Quiñe M.F. & M. Romero. 2007. Estudio Bioecológico y Pesquero-Comercial de Hippocampus ingens "caballito de mar" en el litoral del Perú (Tumbes y Piura) con fines de Conservación. Informe Anual, 2007. 11 p.
Rangel-Dávalos C. 2000. Repoblamiento con la concha nácar Pteria sterna (Gould, 1851) de las islas La Gaviota y San Juan Nepomuceno, Baja California Sur. Universidad Autónoma de Baja California Sur, Área Interdisciplinaria de Ciencias del Mar. Informe final SNIB-CONABIO proyecto No. L096. México.
Reijnen B.T., S.E.T. van der Miej & L.P. van Ofwegen. 2011. Fish, fans and hydroids: host species of pygmy seahorses. ZooKeys. 103: 1 - 26 p.
Reyes-Bustamante H. & A.A. Ortega-Salas. 1999. Cultivo del caballito de mar, Hippocampus ingens (Pisces: Syngnathidae) en condiciones artificiales. Revista de Biología Tropical. 47: 1045 - 1049 p. Rosa I.M.L., R.R.N. Alves, K.M. Bonifácio, J.S. Mourao, F.M. Osório, T.P.R. Oliveira & M.C. Nottingham. 2005. Fishers' Knowledge and seahorse conservation in Brazil. Journal of Ethnobiology and Ethnomedicine. 1-12: 1 - 15 p.
Saavedra M., M. Masdeu, P. Hale, C.M. Sibbons & W.V. Holt. 2014. Dietary fatty acid enrichment increases egg size and quality of yellow seahorse Hippocampus kuda. Animal Reproduction Science. 145: 54 - 61 p.
Sanders J.G., J.E. Cribbs, H.G. Fienberg, G.C. Hulburd, L.S. Katz & S.R. Palumbi. 2008. The tip of the tail: molecular identification of seahorses for sale in apothecary shops and curio stores in California. Conservation Genetics. 9: 65 - 71 p.
Sandoval-Muy M.I. & B.S. Barón. 2007. The effect of two frozen natural foods on the routine metabolism and ammonia excretion of the Pacific seahorse Hippocampus ingens. Journal of fisheries International. 2: 91 - 98 p.
Sandoval-Muy M.I. 2006. Efecto de la dieta congelada sobre la reproducción y calidad de los juveniles del caballito de mar del Pacífico Hippocampus ingens (Girard, 1859) en México. Tesis de Doctorado, Centro de Investigación Científica y de Educación Superior de Ensenada. 146 p.
Segade-Botella A. 2009. Efecto del color del sustrato en el comportamiento de fijación del caballito de mar de hocico corto (Hippocampus hippocampus). Anales Universitarios de Etología. 3: 1 - 6 p.
SEMARNAT. 2002. Norma Oficial Mexicana NOM-059-ECOL-2001, Protección ambiental-especies nativas de México de flora y fauna silvestres-categorías de riesgo y especificaciones para su inclusión, exclusión o cambio-lista de especies en riesgo Diario Oficial de la Federación. 95 - 189 p.
Silveira R.B. & N.F. Ferreira. 2010. Fecundity and fertility of the long snout seahorse, Hippocampus reidi (Teleostei: Syngnathidae), in tropical Brazil. Revista Brasileira de Biociencias. 8: 362 - 367 p.
Storeno L.P. 2004. Hábitos alimentarios y comportamiento trófico del caballito de mar (Hippocampus sp) en la bahía San Antonio (Río Negro). Tesis de Licenciatura, Universidad Nacional de Córdoba. 31 p.
Tanu D., Deobagkar D., Khandeparker R., Sreepada R.A., Sanaye S.V., Pawar H.B. 2012. A study on bacteria associated with the intestinal tract of farmed yellow seahorse, Hippocampus kuda (Bleeker, 1852): characterization and extracelular enzymes. Aquaculture Research. 43: 386 - 394 p.
Tendencia E.A. 2004. The first report of Vibrio harveyi infection in the sea horse Hippocampus kuda Bleekers 1852 in the Philippines. Aquaculture Research. 35: 1292 - 1294 p.
Teske P.R., H. Hamilton, C.A. Matthee & N.P. Barker. 2007. Signatures of seaway closures and founder dispersal in the pylogeny of a circumglobally distributed seahorse lineage. BMC Evolutionary Biology. 7-138: 1 - 19 p.
Teske, P.R. & Beheregaray, L.B. 2009. Evolution of seahorses' upright posture was linked to Oligocene expansion of seagrass habitats. Biology letters, 5, 521-3.
http://dx.doi.org/10.1098/rsbl.2009.0152.
Thampi-Raj S.T., Lipton A.P., Chauhan G.S. 2010. Characterization and infectivity evaluation of Vibrio harveyi causing White patch disease among captive reared seahorses, Hippocampus kuda. Indian Journal of Marine Sciences. 39: 151 - 156 p.
Valladares S. & M. Planas. 2010. Assessment of fin tissue use for stable isotopes analyses in seahorses. European Aquaculture Society, Aquaculture Europe 10. Porto, Portugal.
Valladares S. & M. Planas. 2011. Study of growth in newborn seahorses Hippocampus guttulatus by stable isotopes analyses. World Aquaculture Society, World Aquaculture 2011. Natal, Brazil.
Valladares S. & M. Planas. 2012. Non-lethal dorsal fin sampling for stable isotope analysis in seahorses. Aquatic Ecology. 46: 363 - 370 p.
Verdugo-Díaz G. 2004. Respuesta ecofisiológica del fitoplancton ante la variabilidad ambiental en una Bahía subtropical de Baja California Sur, México. Tesis de doctorado. Centro Interdisciplinario de Ciencias Marinas. 138 p.
Villarreal-Cavazos A., H. Reyes-Bonilla, B. Bermúdez-Almada & O. Arizpe-Covarrubias. 2000. Los peces del arrecife de Cabo Pulmo, Golfo de California, México: Lista sistemática y aspectos de abundancia y biofeografía. Revista de Biología Tropical. 48: 413 - 424 p.
Vincent A.C.J., Sadler, L.M., 1995. Faithful pair bonds in wild seahorses, Hippocampus whitei. Animal Behavior. 50: 1557 - 1569 p.
Vincent A.C.J., S.J. Foster & H.J. Koldewey. 2011. Conservation and management of seahorses and other Syngnathidae. Journal of Fish Biology. 78: 1681 - 1724 p.
Vincent A.C.J. 1995. Trade in seahorses for traditional Chinese medicines, aquarium fishes and curios. Traffic Bulletin. 15: 125-128 p.
Vincent, A. C. J. 1996. The International Trade in Seahorses. Cambridge, London: TRAFFIC International.
Vite-García, N., et al. 2017. Avances en el cultivo de Hippocampus spp. (Teleostei: Syngnathidae): investigaciones en el Siglo XXI. Lat. Am. J. Aquat. Res., 45(1): 1-17,2017.
Woodall L.C., Jones R., Zimmerman B., Guillaume S., Stubbington T., Shaw P. & H.J. Koldewey. 2012. Partial fin-clipping as an effective tool for tissue sampling seahorses, Hippocampuss pp. Journal of the Marine Biological Association of the United Kingdom. 92: 1427 - 1432 p.
Woods C.M.C. & K.M. Martin-Smith. 2004. Visible implant fluorescent elastomer tagging of the big-bellied seahorse, Hippocampus abdominalis. Fisheries Research. 66: 363. 371 p.
Woods C.M.C. 2003a. Effects of varying Artemia enrichment on growth and survival of juvenile seahorses, Hippocampus abdominalis. Aquaculture. 220: 537-548.
Woods C.M.C. 2003b. Effect of stocking density and gender segregation in the seahorse Hippocampus abdominalis. Aquaculture. 218: 167 - 176 p.
Woods C.M.C. 2003c. Growth and survival of juvenile seahorse Hippocampus abdominalis reared on live, frozen and artificial foods. Aquaculture. 220: 287 - 298 p.
Worms. 2017. World Register of Marine Species. www.marinespecies.org.
Palma de mar
Rothman, M.D., Mattio, L., Wernberg, T., Anderson, R.J., Uwai, S., Mohring, M.B. & Bolton, J.J. 2015. A molecular investigation of the genus Ecklonia (Phaeophyceae, Laminariales) with special focus on the southern hemisphere. Journal of Phycology 51(2): 236-246.
EN TEXTO:
Abbott, I. A. y G. J. Hollenberg, 1976. Marine algae of California. Stanford University Press. 827 pp.
Alveal, K., M. E. Ferrario, E. C Oliveira y E. Sar, 1995. Manual de métodos ficológicos. Chile: Universidad de Concepción, Chile, 863 pp.
Bold HC. & MJ. Wynne. 1985. Introduction to the Algae. Structure and Reproduction. 2nd edition. Prentice-Hall, Inc., New Jersey, 662 pp.
Brandt, R. P., 1923. Potash from kelp: Early development and qrowth of the giant kelp Macrocystis pyrifera. U. S. Dept. Agr. Bull. 1191, 40 pp.
Delf, E.M. y M. Levyn (née M. Michell), 1926. Reproduction in Macrocystis pyrifera, Ag. An. Bot. 40: 503-506.
Druehl, L. D., 2000. Pacific Seaweeds. A guide to common seaweeds of the west coast. The Canada Council Fort The Arts Since, Canada. 93 pp.
Druehl, L. D., 1970. The pattern of Laminariales distribution in the northeast Pacific. Phycologia, 9(3), 237-247.
Guiry M.D. in Guiry, M.D. & Guiry, G.M. 2018. AlgaeBase. World-wide electronic publication, National University of Ireland, Galway. http://www.algaebase.org; searched on 03 October 2018.
Peña-Salamanca, E. J. y H. Marín-Salgado, 2016. Ficología aplicada: características, usos y cultivo de algas marinas. Colección: Ciencias Naturales y Exactas. Cali, Colombia, 13-153.
Parada, G. M., R. Riosmena-Rodríguez, E. A. Martínez y G. Hernández-Carmona, 2009. Dinámica poblacional de Eisenia arborea Areschoug (Laminariales: Ochrophyta) en el intermareal de Punta Eugenia, Baja California Sur, México. Cienc. Mar. 13:3-13.
Parada Sánchez, G. M., 2005. Dinámica y variación morfológica de una población intermareal de Eisenia arborea (Laminariales) en Punta Eugenia, BCS, México (Doctoral dissertation, Instituto Politécnico Nacional. Centro Interdisciplinario de Ciencias Marinas).
Sánchez-Barredo, M. 2009. Incorporación de nitrato y duración de las reservas de nitrógeno en la macroalga perenne Eisenia arbórea. Tesis de maestría. Programa de Posgrado en Ciencias en Ecología Marina, Centro de Investigación Científica y de Educación Superior de Ensenada, agosto de 2009, 44 pp.
Zertuche-González, J.A., 1989. Macroalgas y el desarrollo de su cultivo. Cap. 11: 319-337 En: Rosa-Vélez J. de la y F. González-Farias (eds) Temas de Oceanografía Biológica en México. Ensenada 337pp.
http://www.cursosinea.conevyt.org.mx/cursos/mexico/contenidos/recursos/revista/1_2.htm.
Espagueti de mar
Aguilar-Rosas, R., M. E. Cruz-Campas, & A. Trujillo-Ortiz, 2000. Crecimiento de Gracilaria pacifica Abbott (Rhodophyta) en el Estero de Punta Banda, Baja California, México. Hidrobiológica, 10(1): 74-79.
Bast, F., 2014. An Illustrated Review on Cultivation and Life History of Agronomically Important Seaplants. In Seaweed: Mineral Composition, Nutritional and Antioxidant Benefits and Agricultural Uses, Eds Vitor Hugo Pomin, 39-70. Nova Publishers, New York ISBN: 978-1-63117-571-8.
CONABIO, 2016. Gracilaria vermiculophylla (Ohmi) Papenfuss. En Ponderación de Invasividad de Especies Exóticas en México (SIEI). Consultado en octubre de 2016 en https://www.gob.mx/cms/uploads/attachment/file/222541/Gracilaria_vermiculophylla.pdf
CONEVyT, 2018. El territorio nacional. En "Revista". Consultado en octubre de 2018 en http://www.cursosinea.conevyt.org.mx/cursos/mexico/contenidos/recursos/revista/1_2.htm.
Universidad Austral de Chile, Sede Puerto Montt, 2016. Manual para cultivo de macroalgas. Paquete tecnológico: diversificación productiva de las Apes mediante sistemas de cultivos integrados. Proyecto FONDEF HUAM Consultado en octubre de 2018 http://huam.spm.uach.cl/wp-content/uploads/2016/11/Manual-para-Cultivo-de-Macroalgas.pdf.
Dreckmann, Kurt M. y Abel Sentíes 2014. Biodiversidad de Gracilariaceae (Rhodophyta) en México. Revista Mexicana de Biodiversidad, Supl. 85: S69-S75, 2014.
DOI: 10.7550/rmb.40717 69Scagel, R.F., Gabrielson, P.W., Garbary, D.J., Golden, L., Hawkes, M.W., Lindstrom, S.C., Oliveira, J.C. & Widdowson, T.B. 1989. A synposis of the benthic marine algae of British Columbia, southeast Alaska, Washington and Oregon. Phycological Contributions, University of British Columbia 3: [i]-vi, 1-532.
Zertuche-González, J.A., 1989. Macroalgas y el desarrollo de su cultivo. Cap. 11: 319-337 En: Rosa-Vélez J. de la y F. González-Farías (eds) Temas de Oceanografía Biológica en México. Ensenada 337 pp.
Zertuche González, J. A., 1993. Situación actual del cultivo de algas agarofitas en América Latina y el Caribe. Situación actual de la industria de las macroalgas productoras de ficocoloides en América Latina y el Caribe. FAO-Italia. Proyecto Aquila II. Documento de campo, No. 13.
Zertuche-González, J. A., & J. García-Esquivel, 1993. Promoción del cultivo del alga Gracilaria en México. Situación actual de la industria de las macroalgas productoras de ficocoloides en América Latina y el Caribe. FAO-Italia. Proyecto Aquila II. Documento de campo, No. 13.
Almeja chione
Abbott, R. T. 1974. American Sea shells 2 ed. Van Nostrand Reihold Co. New York, 662 p.
Baqueiro, E. C. 1987. Historia, Presente y Futuro del cultivo de bivalvos en México. Memorias III Reunión Nacional de Malacología y Conquiología. México, 458-467.
Baqueiro, E. C. 1989. Clam culture in México: Past, present and future. Elsevier Sci. Amsterdam., 383-394.
Baqueiro, E. C. y Massó, J. A. 1981. Variaciones poblacionales y reproducción de dos poblaciones de Chione undatella (Sowerby, 1835), bajo diferentes regímenes de pesca en la Bahía de La Paz, B.C.S., México.
Baqueiro, E. C., A. Avilés, J. Massó, M. Mucino, P. Rogers y A. Vélez. 1992. Manual de métodos de muestreo y evaluación de poblaciones de moluscos y otros recursos bentónicos. Instituto Nacional de la Pesca. Secretaría de Pesca, México.
Baqueiro, Massó y Guardado. 1982. Distribución y abundancia de moluscos de importancia comercial de Baja California Sur. . Serie de Divulgación Secretaría de Pesca. México.
Brusca, Kimrey and Moore 2004. Nortethern Gulf of California. Chione fluctifraga, Chione californiensis and Chione undatella. Arizona-Sonora Desert Museum. Tucson, Arizona. p 56-57.
Camacho - Evans, M.A. 2011. Abundancia y estructura poblacional de la almeja roñosa Chione californiensis (Broderip, 1835) en el sistema lagunar Navolato, Sinaloa, México. Tesis de Maestría.
Castillo - Durán, J.A. 2013. Aspectos biológicos y ecológicos de la almeja negra Chione fluctifraga (Sowerby, 1853) en Bahía San Jorge, Golfo de California, México. Tesis de Doctorado. Centro de Investigaciones Biológicas del Noroeste. La Paz, B.C.S., México.
Castillo-Durán, A., Castro-Acedo, J.A. Arreola- Lizárraga, F. Hoyos - Chairez, C. Cáceres- Martínez, R.
Mendoza- Salgado, L.R. Martínez-Córdova, J. Chávez-Villalba 2013. Ciclo gametogénico e índice de condición de la almeja Chione fluctifraga en Bahía San Jorge, Golfo de California, México. Rev. Biol. Mar. Oceanogr. 48 (1):59-72.
Castro-Ortiz, J. L. & F. García-Domínguez.1993. Crecimiento de Chione californiensis (Broderip, 1835) (Veneridae) en la Ensenada de La Paz, Baja California Sur. México. Investigaciones Marinas CICIMAR, 8 (2): 46-51.
Coan E.V. & P. ValentichScott. 2012. Bivalve shells of tropical west America: marine bivalve mollusks from Baja California to northern Perú. Santa Barba. Museum of Natural History, Monograph. 6(4): 749-758.
CONAPESCA. (2010-2017) Información Estadística de Especie y Entidad.
CONAPESCA. (2011-2017) Anuario Estadístico de Acuacultura y Pesca.
FAO. 1995. Code of conduct for responsible fisheries. FAO, Roma. 41p.
FAO. 1996. Precautionary approach to capture fisheries and species introductions. FAO Technical Guidelines for Responsible Fisheries. No. 2. FAO, Roma. 54 pp.
Flores- Pérez, A. 2017. Biología Reproductiva de la almeja roñosa, Chione californiensis (Broderip, 1835) en Bahía Magdalena, B.C.S., México. Tesis de Maestría. Centro Interdisciplinario de Ciencias Marinas. Instituto Politécnico Nacional. La Paz, B.C.S., México.
García- Hirales, R., Guevara- Escamilla, S., Sáenz- Gaxiola, L.M. y Tapia - Vázquez, O. 2010. Situación Actual de los laboratorios de producción comercial de moluscos bivalvos en el noroeste de México. Comité Estatal de Sanidad Acuícola e Inocuidad de Baja California, A.C.(CESAIBC).
García-Domínguez, F. 1991. Distribución, abundancia, reproducción y fauna asociada de la almeja roñosa, Chione californiensis, en la Ensenada de La Paz, B. C. S., México. Tesis de Maestría. CICIMAR-IPN, México.
García-Domínguez, F. A. 2002. Estrategias reproductivas de bivalvos marinos en el Noroeste de México. Tesis de Doctorado. Universidad de Colima. Colima. 119 p.
García-Domínguez, F. A., & A. Levy-Pérez. 1994. Ciclo reproductor de la almeja roñosa Chione californiensis Broderip, 1835 (Veneridae) en la Ensenada de La Paz, Baja California Sur, México. Revista de Investigación Científica, UABCS, 5(2): 37-42.
García-Domínguez, F. A., B. González-Acosta & S. Rodríguez-Astudillo. 1991. Fauna simbionte de la almeja roñosa, Chione californiensis en la Ensenada de La Paz, Baja California Sur, México. Investigaciones Marinas CICIMAR, 6 (2): 283-286.
García-Domínguez, F. A., G. García-Melgar & P. González-Ramírez. 1993. Ciclo Reproductivo de la almeja roñosa, Chione californiensis (Broderip, 1835), en Bahía Magdalena, Baja California Sur. México. Ciencias Marinas, 19 (1): 15- 28.
García-Domínguez, F. A., M. Villalejo-Fuerte & S. Rodríguez -Astudillo. 2008. Reproductive Cycle of Chione fluctifraga (Sowerby, 1853) (Bivalvia Veneridae) during La Niña 1998-1999 at Ojo de Liebre Lagoon, Baja California Sur, México. Physiomar 08. Physiological aspects of reproduction, nutrition and growth. "Marine molluscs in a changing environment".111 p.
García-Domínguez, F. A., M. Villalejo-Fuerte, O. Holguin-Quiñones, S. RodríguezAstudillo & E. F. Félix-Pico. 2011. Ciclo reproductivo de Chione californiensis (Broderip, 1835) (Mollusca: Veneridae) en la Ensenada de La Paz, B.C.S., México durante el año "El Niño" de 1997. Boletín de la Sociedad Internacional de Malacología Médica y Aplicada. 17: 4-6.
Gutiérrez-Vásquez, I. 2007. Maduración y Obtención de semilla de la almeja negra, Chione fluctifraga (Sowerby, 1853), bivalvia: veneridae, de las costas de Sonora, México. Tesis de Maestría, Universidad de Sonora, Hermosillo, 150p.
Keen, A, M. 1971 Sea shells of tropical West América. Marine mollusks from Baja California, Stanford. Univ. Press. Satnford, 1025 p.
Martínez - Córdova, L.R. 1986. Abundancia y distribución por talla de la almeja negra Chione fluctifraga en el estero La Cruz, Sonora. Ciencias Marinas. 13 (2): 25-33.
Martínez - Córdova, L.R. 1988. Bioecología de la almeja negra Chione fluctifraga (Sowerby, 1853). Rev. Bio. Trop. 36:213-219.
Martínez - Córdova, L.R. 1996. Contribución al conocimiento de la fauna malacológica de cuatro lagunas costeras del Estado de Sonora, México. Ciencias Marinas 22: 191-203.
Martínez- Córdova, L.R., L.F. Enríquez - Ocaña, F. López-Rascón, J.A. López-Elías, M. Martínez -Porchas. 2013. Overwintering the black clam Chione fluctifraga in a tidal shrimp pond and in an estuary, using suspended and bottom systems. Aquaculture. 396: 102-105.
Martínez-Córdova, L.R. y J.A. López-Elías, M. Martínez-Porchas, T. Bernal-Jaspeado, A. Miranda- Baeza. 2011. Studies on the bioremediation capacity of the adult black clam, Chione fluctifraga, of shrimp culture effluents. Rev. Biol. Mar. Oceanogr. 46 (1)1: 105-113.
Moore, H. V. y N. N. Lopez. 1969. The ecology of Chione cancellata. Bull. Mar. Sci. (19): 131-148.
Olivares- Bañuelos, T., García-Pamares, J., Gonzales-Gómez, M.A., Rodríguez- Gonzales. 2017. Firts description of growth, development and rearing of the sandy clam Chione cortezi (Bivalvia, Veneridae) (Carpenter, 1864). Instituto de Investigaciones Oceanológicas, Universidad Autónoma de Baja California, México. Pan- American Journal of Aquatic Sciences.
Prado- Ancona, J.D. 1998. Ciclo reproductivo de tres poblaciones de Chione californiensis Broderip, 1835 (Bivalva: Verenidae) en Baja California Sur, México. Tesis de Maestría. Centro Interdisciplinario de Ciencias.
Marinas (CICIMAR). Instituto Politécnico Nacional. La Paz, B.C.S. México.
Rodríguez-Arana, C.O. 2016. Efecto de la temperatura y la densidad de cultivo en la supervivencia y crecimiento de juveniles de almeja arenera (Chione cortezi) en un sistema de recirculación acuícola. Tesis de Maestría. Centro de Investigación Científica y Educación Superior de Ensenada, Baja California (CECISE). México.
Schöne, B. R., Lega, J., Flessa, K. W., Goodwin, D. H., y Dettman, D. L. 2002. Reconstructing daily temperatures from growth rates of the intertidal bivalve mollusk Chione cortezi (northern Gulf of California, México). Palaeogeography, Palaeoclimatology, Palaeoecology, 184(1-2), 131-146.
Shöne, B.R., D.H. Goodwin, K.W. Flessa, D.L. Dettman, P.D. Roopnarine. 2002. Sclerochronology and growth of the bivalve mollusks Chione fluctifraga and C. cortezi in the northern Gulf of California, México. The Veliger. 45: 45-54.
Tejada-Cabrera, C.R. 2017. Estrategia de desove de Chione californiensis (Broderip, 1835) (Bivalva: Veneridae) en la ensenada de la Paz, B.C.S., México. Tesis de Maestría. Centro Interdisciplinario de Ciencias Marinas. La Paz, B.C.S., México.
Tripp-Quezada, A. 2008. Comunidades de moluscos asociados a ambientes de carbonatos modernos en el del Golfo de California. Tesis de doctorado. CICIMAR. México.
Villarreal-Chávez, G; García-Domínguez, F; Correa, F; Castro - Castro, N. 1999. Nota sobre la distribución geográfica de Chione cortezi (Carpenter, 1864) (Mollusca: Pelecypoda: Veneridae) Ciencias Marinas, 25 (1): 153-15.
Pez payaso
Allen, G.R. y D.R. Robertson. 1994. Fishes of the tropical Eastern Pacific. Univ. Hawaii. Press. Honolulu. 322 pp.
Balfour-Hepher, 1988, Nutrición de peces comerciales en estanques, Editorial LImusa, 1993.
Joyce D. Wilkerson, 1997. Clownfishes: A Guide to Their Captive Care, Breeding & Natural History.
Matthew L. Wittenrich, 2007. The complete Ilustrated Breeders Guide to Marine Aquarium fishes. Published by Microcosm, TFH Publications.
Martin Moe A, Jr. 1997. Breeding the orchid dottyback (Pseudochromis fridmani), an aquarist journal, Green Turtle Pubns.
Piña, E.R. 2000a. Catálogo de identificación de peces marinos de importancia ornamental del Golfo de California y Pacífico. Informe Técnico del Instituto Nacional de la Pesca (inédito). 45 p.
Totoaba
Barrera Guevara, J.C. 1990. The conservation of Totoaba macdonaldi (Gilbert), (Pisces: Sciaenidae), in the Gulf of California, Mexico. J. Fish Biol. 37 (Suppl. A):201-202.
Berdegue, A.J. 1955. La pesquería de la totoaba (Cynoscion macdonaldi Gilbert) en San Felipe, Baja
California. Revista de la Sociedad Mexicana de Historia Natural 16:45-68.
Chao, L.N., 1995. Sciaenidae. Corvinas, barbiches, bombaches, corvinatas, corvinetas, lambes, pescadillas, roncachos, verrugatos. P. 1427-1518. A: W. Fischer, F. Krupp, W. Schneider, C. Sommer, K.S. Carpenter y V. Niem (eds.) Guía FAO para identificación de especies para los fines de pesca. Pacifico Centro-oriental. 3 volúmenes. 1813 p.
Cisneros-Mata, M.A., G. Montemayor-Lopez and M.J. Roman_Rodriguez. 1995. Life history and conservation of Totoaba macdonaldi. Conservation Biology. 9:806-814.
Cisneros, M. M.A. 2018. Informe Final "Evaluación de la Población de Totoaba en el Golfo de California". Centro Regional de Investigación Pesquera y Acuacultura-Guaymas. SAGARPA. Instituto Nacional de Pesca y Acuacultura. Pp. 97.
CITES SC71 Doc. 17. Documento de trabajo del Comité Permanente #71. Registro de establecimientos que crían en cautividad especies de fauna incluidas en el apéndice I con fines comerciales: Registro del establecimiento "Earth Ocean Farms. S. de R.L. de C.C." que cría en cautividad Totoaba macdonaldi. https://cites.org/sites/default/files/esp/com/sc/71/S-SC71-17.pdf.
Instituto de Acuacultura del Estado de Sonora, OPD. 2014. Mantenimiento, maduración y reproducción de crías de totoaba (Totoaba macdonaldi). Hermosillo, Sonora, México.
Juárez, MJ., P.A. Konietzko, M.H. Schwarz. 2016. Totoaba aquaculture and conservation: Hope for an endangered fish from Mexico´s Sea of Cortez. World Aquaculture. Pp. 30-38. Dec. 2016.
Peet, R. 2009. The totoaba croaks. Justseeds.org/the-totoaba croaks/#comment19754.
Totoaba macdonaldi (http://fishbase.org/Summary/Species Summary.php? gfenusname=Totoaba&speciesname=macdonaldi). En Fish Base (Rainer Froese y Daniel Pauly, eds.). Consultada en enero de 2017. N.p.: FishBase, 2017.
True, C.D., L. Acuna, G. Sandoval, I.M. Diaz and N.C. Castro. 2009. Avance tecnológico para el desarrollo de la biotecnología de cultivo de Totoaba macdonaldi (Technological advances in the development of aquaculture biotechnology for Totoaba macdonaldi). Universidad Autónoma de Baja California, Ensenada, México.
True, C.D. 2012. Desarrollo de la biotecnología de cultivo de Totoaba macdonaldi (Developing aquaculture biotechnology for Totoaba macdonaldi). Ph.D. Dissertation. Universidad Autónoma de Baja California, Ensenada, México.
Valenzuela-Quiñonez, F. 2014. Genética y dinámica poblacional de la totoaba (Totoaba macdonaldi, Gilbert, 1891) en el Golfo de California. Ph.D. Thesis. Centro de Investigaciones Biológicas del Noroeste. La Paz, Baja California Sur, México.
Coral
Banaszak, A., Schutter, M., Guendulain-García, S., Mendoza-Quiroz, S., Gómez-Campo, K. 2018. Guía práctica para la restauración con base en la producción de reclutas sexuales de corales con énfasis en Acropora palmata. UASA-Puerto Motrelos, ICMyL, UNAM.
Forsman, Z.H., Page, C.A., Toonen, R.J. Vaughan, D. 2015. Growing coral larger and faster: micro-colony-fusion as a strategy for accelerating coral cover. PeerJ 3:1313; DOI 10.7717/peerj.1313.
Johnson, M. E., C. Lustic, E. Bartels, I. B. Baums, D. S. Gulliam, L. Larson, D. Lirman, M. W. Miller, K. Nedimyer, S. Schopmeyer. 2011. Caribbean Acropora Restoration Guide: Best Practices for Propagation and Population Enhancement. The Nature Conservancy, Arlingon, V. A.
Padilla Souza, A. C., González Cano, J., Banaszak, A., Hernández Arana, H., Raigoza Figueras, R. 2018. Programa interdisciplinario de restauración activa para compensar daños antropogénicos en arrecifes coralinos del caribe mexicano. Instituto Nacional de Pesca y Acuacultura. Informe final SNIB-CONABIO, proyecto No. JA009. Ciudad de México.
Padilla-Souza, C., Ramírez-Mata, E. Soto, M., González-Cano, J. e Ibarra-Navarro, R. 2017. Programa de restauración de arrecifes coralinos: El caso de dos áreas afectadas por encallamiento. Proceedings of the 69th Gulf and Caribbean Fisheries Institute. November 7-11, 2016. Grand Cayman, Cayman Islands. 352-361 pp.
Page, C.A. 2013. Reskinning a reef: Mote marine scientists explore a new approach to reef restoration. In: Coral: The Reef and Marine Aquarium Magazine, pp. 72-81.
Page, CA., Muller, E., Vaughan, D. 2018. Microfragmenting for the successful restoration of slow growing massive corals. Ecological Engineering 123:86-94pp.
Jaiba azul
Anuario Estadístico de Acuacultura y Pesca 2013. www.conapesca.gob.mx SAGARPA. pp29.
Boletín de Comercio Exterior 2014.Comercio Exterior de Acuacultura y Pesca. www.conapesca.gob.mx SAGARPA. PP6 Y 18.
Palacios Fest M.R, 2000. La Jaiba Biología y Manejo. AGT EDITOR, S.A. pp150.
Palacios Fest, M.R. 2017 Aspectos Biológicos Pesqueros para la Norma Oficial Mexicana del Recurso Jaiba en el Golfo de México y Caribe Mexicano. Congreso Internacional de Recursos Naturales 2017 CDMX Septiembre 6-7 y 8.
Francisco Javier Bacab Cahuich1, Luis Enrique Amador del Angel1, Raúl Valdes Alonso2, Patricia Cabrera Rodríguez3. Cultivo de larvas de la Jaiba Azul Callinectes sapidus en condiciones de laboratorio en la Isla del Carmen, Campeche, México 2012. CIVA 2002 (http://www.civa2002.org), 122-128.
Cultivo de Jaiba en Taiwan. División de Televisión Educativa y Cultural de INRAVISION y la Universidad Agraria de .Colombia www.youtube,com.
Medregal limón
Price, C.S. and J.A. Morris, Jr. 2013. Marine Cage Culture and the Environment: Twenty-first Century Science Informing a Sustainable Industry. NOAA Technical Memorandum NOS NCCOS 164. 158 pp.
Roo, J., Fernández-Palacios, H., Hernández-Cruz, C. M., Mesa- Rodríguez, A., Schuchardt, D., & Izquierdo, M. 2014. First results of spawning and larval rearing of longfin yellowtail Seriola rivolianaas a fast- grow-ing candidate for European marine finfish aquaculture diversification. Aquaculture Research, 45, 689- 700.
Sicuro, B., Luzzana, U., 2016. The state of Seriola spp. other than yellowtail (S. quinqueradiata) farming in the world. Rev. Fish. Sci. Aquac. 24, 314- 325. https://doi.org/10.1080/23308249.2016.1187583.
Whittington, I.D., Corneillie, S., Talbot, C., Morgan, J.A.T., Adlard, R.D., 2001. Short communication Infections of Seriola quinqueradiata Temminck & Schlegel and S. dumerili (Risso) in Japan by Benedenia seriolae (Monogenea) con rmed by morphology and 28S ribosomal DNA analysis 421-425.
Medusa bola de cañón
Álvarez-Tello, F.J., López-Martínez, J. 2015. Trophic spectrum and feeding pattern of cannonball jellyfish Stomolophus meleagris (Agassiz, 1862) from central Gulf of California. 2015. Journal of the Marine Biological Association of the United Kingdom. 59(6): 1217-1227.
González-Valdovinos, M.I. 2010. Alimentación y desarrollo en la fase pólipo de la medusa bola de cañón Stomolophus meleagris L. Agassiz, 1860 (Scyphozoa, Rhizostomida). Tesis de Licenciatura. Universidad Autónoma de Baja California Sur. La Paz, B.C.S. México. 46p.
López-Martínez, J. & F.J. Álvarez-Tello. 2013. The Jellyfish fishery in México. Agricultural Sciences 4 (6A): 57-61.
López-Martínez, J., Álvarez-Tello, J., Navarro-Fernández, M., Cisneros-Mata, M.A. Ross-Guerrero, M., Soto-Murillo, C., Arzola-Sotelo, E.A. 2018. La medusa en México: importancia socioeconómica y su futuro en la acuacultura. Panorama Acuícola, 23(3): 56-61.
Ocampo-Victoria, L., P. Monsalvo-Spencer, M. González-Valdovinos, J. López-Martínez. 2008. Descripción del desarrollo larvario y post-larvario de la medusa bola de cañón Stomolophus meleagris en condiciones controladas. XV congreso nacional de ciencia y tecnología del mar. Villahermosa, Tabasco. Noviembre 2008.
Padilla-Serrato J.G., López-Martínez J., Acevedo-Cervantes A., Alcántara-Razo E. and Rábago-Quiroz C.H. 2013. Feeding of the scyphomedusa Stomolophus meleagris in the coastal lagoon Las Guásimas, northwest Mexico. Hidrobiológica 23(2), 218-226.
Ruppert, E., R. Barnes. 1996. Zoología de invertebrados. McGraw Hill. México, D.F. 1114p.
Sistemas lagunares
FAO. Organización de las Naciones Unidas para la Agricultura y la Alimentación, 1995. EstudioPiloto para un plan de Desarrollo Acuícola en el Sistema Lagunar de Alvarado, Ver.México DF.
BENÍTEZ C L., G. 2011. "Textura de sedimentos y carbono orgánico en el sistema costero lagunar Alvarado, Veracruz." Contactos 81 (1): 11-16.
LAGUNA CARMEN-MACHONA. Anales del Instituto de Ciencias del Mar y Limnología. UNAM.http://biblioweb.tic.unam.mx/cienciasdelmar/instituto/1983-1/articulo162.html.
BRAVO-PEÑA, L.C., A. Espinoza-Tenorio y C. E. Medina-Reyna. 2006. La evaluación territorial para la acuacultura costera bajo un enfoque de sustentabilidad. Dos casos de estudio para el Pacífico sur mexicano. Instituto de Ecología. Volumen III, Sección VII, p. 1017-1044.
BURRESON E.M., R. Sima-Alvarez, V.M. Vidal-Martínez and M.L. Aguirre-Macedo. 1994. Perkinsus marinus (Apicomplexa) as a potential source of oyster Crassostrea virginica mortality in coastal lagoons of Tabasco, México. Diseases of aquatic organisms 20: 77-82.
CARRILLO P., B. C. Quiroga, Ch. Castañeda, M R., Wakida, K. A., Marquez G. E., R.M. Loran, I R. Martínez, F. J. Villanueva. 2012. Plan de manejo pesquero del sistema lagunar Carmen - Pajonal - Machona, Tabasco: Una actividad pesquera sustentable. SAGARPA - INAPESCA -CONACyT - ITBOCA. 408 p.
GOLD, B., G., O. Zapata, R. Sima y V. Ceja. 1996. Contaminantes tóxicos en las lagunas costeras de Tabasco, México. Resumenes X Congreso Nacional de Oceanografía. Noviembre 1996.
GÓMEZ, A. H. 1978. Distribución de salinidades del sistema lagunar costero del Carmen-Pajonal-Machona. Tabasco, México. Ciencias Marinas. 5 (2): 87-95.
GRANADOS, B. A. y J. L. Ramos. 1993. Comportamiento de la salinidad, temperatura, oxígeno disuelto y pH superficial de un sistema lagunar costero del estado de Tabasco México. Res. V Congreso Latinoamericano de Ciencias del Mar. 247 p.
GUTIÉRREZ, M., A. Galaviz y A. Castro. 1978. Fisiografía y sedimentos recientes de las lagunas El Carmen y Machona, Tabasco, México. VI Congreso Nacional de Oceanografía. 155 p.
GUTIÉRREZ, M., A. Galaviz S. y A. Castro R. 1990. Morfosedimentología de dos lagunas del Golfo de México. Resumen II Congreso de Ciencias del Mar. 188 p.
GUTIÉRREZ-ESTRADA, M. y A. Galaviz-Solís, 1983. Morfología y sedimentos recientes de las lagunas El Carmen, Pajonal y La Machona, Tabasco. México. Anales del Instituto de Ciencias del Mar y Limnología. 10 (1): 249-270.
HERNÁNDEZ-SANTANA, J. R., Ortiz-Pérez, M. A., Méndez-Linares A. P., L Gama- Campillo. 2008. Morfodinámica de la línea de costa del estado de Tabasco, México: tendencias desde la segunda mitad del siglo XX hasta el presente.
Investigaciones Geográficas, Boletín del Instituto de Geografía, UNAM. 65, 2008, 7-21.
JIMÉNEZ, A. R. 1987. Modelo hidrodinámico numérico del sistema lagunar Carmen-Pajonal-Machona, Tabasco. Resumen II Reunión Indicativa de Actividades Regionales Relacionadas con la Oceanografía (Golfo de México y Mar Caribe Mexicanos. 41 p.
ORTIZ, G. y N. Peña, 1993. Sucesión ecológica provocada por explotación petrolera y la apertura de "Boca de Panteones" en el sistema lagunar Carmen-Machona-Arrastradero, Cárdenas, Tabasco. XII Congreso Mexicano de Botánica. 198 p.
ORTIZ-GALLARZA, S. M., A. Hernández- Llamas, A Ortega - Rubio. 2005. Diseño, construcción y aplicabilidad del índice de evaluación ambiental de Ecosistemas Acuáticos (IEAEA). Interciencia 3: 30pp.
QUINTANA Y MOLINA, J. R. 1983. Estudio del macrobentos del sistema lagunar Carmen y Machona en Tabasco, Méx. Resumen VII Congreso Nacional de Zoología, 171 p.
ROMERO, J y H. Rodríguez, 1982. Niveles actuales de contaminación coliforme en el sistema lagunar El Carmen-Machona, Tabasco, México. Anales Institucionales de Ciencias del Mar y Limnología UNAM 9 (1): 121-126.
RUEDA, L., 1993. Determinación de plaguicidas organoclorados en sedimentos y organismos (moluscos y peces) de lagunas costeras en el sureste de México. Tesis de licenciatura. ENEP-Iztacala, UNAM. 78 p.
SANTOYO, H y M. Signoret. 1981. Producción primaria planctónica de tres lagunas costeras de México. Resumen VII Simposio Latinoamericano de Oceanografía Biológica, 45 p.
SILVA, G. A., R. Olivarí M., G. Yany G. 1999. Determinación de distritos de aptitud acuícola mediante la aplicación de sistemas de información geográfica. Investigaciones Marinas. Escuela de Ciencias del Mar, Universidad Católica de Valparaíso, Chile. 27: 93-99.
Trucha nelsoni
Garduño-Franco, J. C. 1994. Desarrollo ontogénico, supervivencia y crecimiento de la trucha arcoiris de San Pedro Mártir, Oncorhynchus mykiss nelsoni (Evermann), en condiciones de semicultivo. Tesis (maestría). Facultad de Ciencias Marinas, Universidad Autónoma de Baja California. Ensenada, Baja California, México.
Ruiz-Campos. G. 1993. Bionomía y ecología poblacional de la trucha arcoíris. Oncorhynchus mykiss nelsoni (Evermann) de la Sierra San Pedro Mártir. Baja California. México. Tesis de Doctorado. Universidad Autónoma de Nuevo León. Monterrey. México.
Ruiz-Campos. G. & E.P. Pisler. 1995. Distribution, habitat and current status of the San Pedro Martir rainbow trout. Oncorhynchus mykiss nelsoni (Evermann) Bull. Soulh, Calif. Acad. Sci. 94: 131·148.
Ruiz-Campos, G., S. Contreras-Balderas, J. L. Castro-Aguirre, M. L. Lozano-Vilano, A. F. González-Acosta y S. SánchezGonzáles. 2003. An annotated distributional checklist ofthe freshwater fish from Baja California Sur, México. Reviews in Fish Biology and Fisheries 12:143-155.
Ulva
Abbott, I. A. & G. J., Hollenberg. 1976. Marine algae of California. Stanford, CA: Stanford Univ. Press. 827 pp.
Ben-Ari, T., Neori, A., Ben-Ezra, D., Shauli, L., Odintsov, V., & Shpigel, M. 2014. Management of Ulva lactuca as a biofilter of mariculture effluents in IMTA system. Aquaculture, 434, 493-498.
Chávez S., C. & Higuera C., I. 2003. Manual de Buenas Prácticas de Producción Acuícola de Camarón para la Inocuidad Alimentaria. SENASICA, CIAD, AC. https://www.gob.mx/senasica.
Cormaci, M., Furnari, G., & Alongi, G. 2014. Flora marina bentonica del Mediterraneo: Chlorophyta. Bollettino delle sedute della Accademia Gioenia di Scienze Naturali in Catania, 47, 11-436.
Cruz-Suárez LE, Tapia-Salazar M, Nieto-López MG, Guajardo-Barbosa C, Ricque-Marie D. 2008. Comparison of Ulva clathrata and the kelps Macrocystis pyrifera and Ascophyllum nodosum as ingredients in shrimp feeds. Aquaculture Nutrition 15:421-430.
Cruz-Suárez LE, Tapia-Salazar M, Nieto-López MG, Ricque-Marie D. 2009. Use of Seaweeds for Shrimp Nutrition: Status and Potential. The Rising Tide. Proceedings of the Special Session on Sustainable Shrimp Farming. Edited by: Craig L. Browdy and Darryl E. Jory. World Aquaculture Society. USA. Pp. 131-147. ISBN: 978-1-888807-08-0.
Cruz-Suárez L E, León A, Peña-Rodríguez A, Rodríguez-Peña G, Moll B, Ricque-Marie D. 2010. Shrimp/Ulva co-culture: a sustainable alternative to diminish the need for artificial feed and improve shrimp quality. Aquaculture 301(1-4):64-68.
Druehl, L. 2000. Pacific seaweeds: a guide to common seaweeds of the West Coast. Harbour Publishing, Madeira Park, B.C.
Grote, B. 2016. Bioremediation of aquaculture wastewater: evaluating the prospects of the red alga Palmaria palmata (Rhodophyta) for nitrogen uptake. J Appl Phycol 28:3075-3082.
Hayden, H. S., Blomster, J., Maggs, C. A., Silva, P. C., Stanhope, M. J., & Waaland, J. R. 2003. Linnaeus was right all along: Ulva and Enteromorpha are not distinct genera. European journal of phycology, 38(3), 277-294.
Lawton, R. J., Mata, L., de Nys, R., & Paul, N. A. 2013. Algal bioremediation of waste waters from land-based aquaculture using Ulva: selecting target species and strains. PLoS One, 8(10), e77344.
Lee R. E., 1999, Phycology. Cambridge University Press, III: 614pp.
Matos, J., S. Costa, A. Rodrigues, R. Pereira & I. Sousa. 2006. Experimental integrated aquaculture of fish and red seaweeds in northern Portugal. Aquaculture, 252: 31-42.
Neori, A., Chopin, T., Troell, M., Buschmann, A. H., Kraemer, G. P., Halling, C., Shpigel, M. & Yarish, C. 2004. Integrated aquaculture: rationale, evolution and state of the art emphasizing seaweed biofiltration in modern mariculture. Aquaculture, 231(1-4), 361-391.
Peña Rodríguez, A., León, A., Moll, B., TapiaSalazar, M., Nieto-López, M.G., Villarreal-Cavazos, D., RicqueMarie, D. y Cruz-Suárez, L.L. 2010. Uso de Ulva clathrata en la nutrición del camarón blanco: revisión. En: Cruz-Suarez, L.E., Ricque-Marie, D., TapiaSalazar, M., Nieto-López, M.G., Villarreal-Cavazos, D. A.,
Gamboa-Delgado, J. (Eds), Avances en Nutrición Acuícola X - Memorias del X Simposio Internacional de Nutrición Acuícola, 8-10 de Noviembre, San Nicolás de los Garza, N. L., México. ISBN 978-607-433-546-0. Universidad Autónoma de Nuevo León, Monterrey, México, pp. 700-712.
Pereira, L., & Correia, F. (2015). Macroalgas marinhas da costa portuguesa - biodiversidade, ecologia e utilizações. 1ª ed. Paris, França: Nota de Rodapé.
11. ABREVIATURAS Y SIGLAS
| °C | Grados Celsius o centígrados |
| BC | Baja California |
| BCS | Baja California Sur |
| Cm | Centímetro |
| COFEPRIS | Comisión Federal para la Protección de Riesgos Sanitarios |
| CONAGUA | Comisión Nacional del Agua |
| CONAMER | Comisión Nacional de Mejora Regulatoria |
| CONAPESCA | Comisión Nacional de Pesca y Acuacultura |
| CINVESTAV | Centro de Investigación y de Estudios Avanzados |
| CRIAP | Centro Regional de Investigación Acuícola Pesquera |
| EUA | Estados Unidos de América |
| G | Gramos |
| Ha | Hectárea |
| INAPESCA | Instituto Nacional de Pesca y Acuacultura |
| Kg | Kilogramos |
| l ó L | Litro |
| M | Metros |
| m2 | Metros cuadrados |
| m3 | Metros cúbicos |
| µg | Microgramos |
| Min | Minutos |
| MXN | Peso mexicano |
| Mg | Miligramo |
| Msnm | Metros sobre el nivel del mar |
| ND | No disponible |
| NMP | Número más Probable |
| Ph | Potencial de hidrógeno |
| SCT | Secretaria de Comunicaciones y Transportes |
| SENASICA | Servicio Nacional de Sanidad, Inocuidad y Calidad Agroalimentaria |
| SEMAR | Secretaría de Marina |
| SEMARNAT | Secretaría de Medio Ambiente y Recursos Naturales |
| Son. | Sonora |
| sp. | Especie |
| spp. | Especies |
| SRA | Sistemas de Recirculación Acuícola |
| USD | Dólares Estadounidenses |
| Ups | Unidades Prácticas de Salinidad |
| UMA | Unidades de Manejo para la Conservación de la Vida Silvestre |
_________________________